- スクリーニング受託サービス
- Dharmaconスクリーニングライブラリー
- CRISPRmod CRISPRa化学合成crRNAライブラリー
CRISPRmod CRISPRa化学合成crRNAライブラリー
アルゴリズムで最適化されたガイドRNA設計により、高い特異性と機能性を実現

CRISPRmod CRISPRa化学合成crRNAアレイ化ライブラリーにより、ハイコンテントアッセイを用いた1 gene/ウェルの調査が可能になり、詳細な生物学的疑問への回答が得られます。CRISPR遺伝子転写活性化スクリーニングをご利用になり、創薬、パスウェイ解析、疾患に関する研究を推進してください。
ご希望の遺伝子ファミリーが見つからない場合は、Cherry-Pick Custom Library Toolからご希望のライブラリーを構成いただけます。お客様のご希望の遺伝子をアップロードし、カスタマイズされたCRISPRaスクリーニングライブラリーを構成し、ご注文いただけます。
Highlights:
- 1遺伝子につき4つのcrRNA、または4つのcrRNAのプールとして利用でき、非常に効果的な遺伝子転写活性化を提供します(Supporting Dataタブを参照してください)。
- crRNAプールフォーマットは、4つのcrRNAを使用する場合と比較して、ライブラリーのコスト、保管、取り扱いを削減しながら、強固な遺伝子転写活性化を提供することができます。
- アルゴリズムが作製したデザイン(Horlbeck, et. al.1)は、強固な遺伝子転写活性化を実証しています(Referencesタブを参照してください)。
- 化学的修飾がほどこされたCRISPRa crRNAおよびtracrRNAは、ヌクレアーゼ分解に対するさらなる安定性を提供し、全体的な性能を向上させます。
- 96ウェルまたは384ウェルプレートで便利にアレイ化され、遺伝子ファミリーコレクションとして提供されます。Echo-qualified 384ウェルプレートは、ご要望に応じて提供可能です。
化学合成crRNAを用いたCRISPRa遺伝子転写活性化実験に必要なコンポーネント:
- dCas9-VPR2用のレンチウイルス発現プラスミドまたはレンチウイルス粒子;VPR活性化ドメインと融合した哺乳類コドン最適化S. pyogenes不活性化Cas9
- CRISPRa crRNAは、SunTag technology3にも対応しています。
- trans-activating CRISPR RNA (tracrRNA)
| Human CRISPRa crRNA Libraries | # genes (approximate) | Catalog # (Pool/Set of 4) |
|---|---|---|
| Cell Cycle Regulation | 169 | GP/GC-103205-xx |
| Cytokine Receptors | 110 | GP/GC-104005-xx |
| Deubiquitinating Enzymes | 94 | GP/GC-104705-xx |
| DNA Damage Response | 240 | GP/GC-106005-xx |
| Drug Targets | 3686 | GP/GC-104650-xx |
| Druggable Genome* | 8422 | GP/GC-104605-xx |
| Epigenetics | 835 | GP/GC-106105-xx |
| G Protein-coupled Receptors | 390 | GP/GC-103605-xx |
| Genome | 19,127 | GP/GC-105005-xx |
| Ion channels | 417 | GP/GC-103805-xx |
| Membrane Trafficking | 140 | GP/GC-105505-xx |
| Nuclear Receptors | 52 | GP/GC-103405-xx |
| Phosphatases | 254 | GP/GC-103705-xx |
| Proteases | 576 | GP/GC-105105-xx |
| Protein Kinases | 746 | GP/GC-103505-xx |
| Transcription Factors | 1580 | GP/GC-105805-xx |
| Tyrosine Kinases | 90 | GP/GC-103105-xx |
| Ubiquitin Enzymes | 738 | GP/GC-106205-xx |
*Druggable genomeは、Proteases、Protein Kinases、Phosphatases、Transcription Factors、Ubiquitin Enzymes、GPCRs、Ion Channels and Drug Targetsで構成されています。
複数のdCas9-VPR安定化発現細胞における化学合成crRNAを用いた効率的な転写遺伝子の活性化
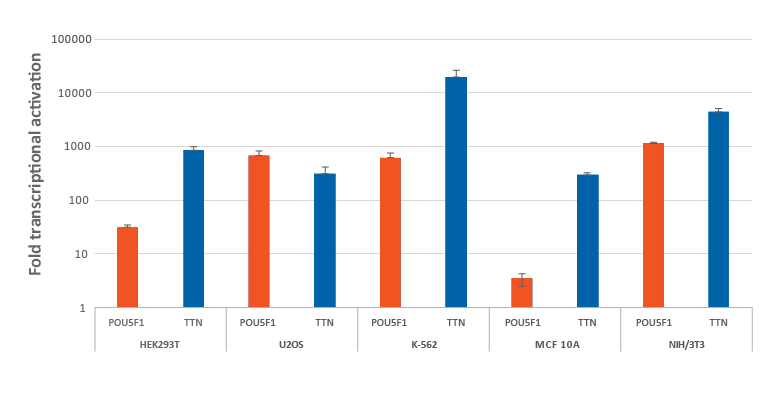
dCas9-VPRを安定的に発現するHEK293T、U2OS、MCF 10A、NIH/3T3を10,000細胞/ウェルでプレーティングし、DharmaFECT トランスフェクション試薬を用いてPOU5F1およびTTNを標的とするCRISPRa化学合成crRNA:tracrRNA(25 nM)をトランスフェクションしました。K562細胞は、POU5F1およびTTNを標的とするCRISPRa化学合成crRNA:tracrRNA(400 nM)をエレクトロポレーションしました。トランスフェクション後72時間で細胞を回収し、RT-qPCRを用いて相対的な遺伝子発現を測定しました。各遺伝子の相対的な転写活性化倍率は、GAPDHを対照遺伝子としてCq法で算出し、non-targetingコントロールに正規化しました。
U2OS細胞におけるCRISPRa遺伝子の活性化は24時間で観察され、48~72時間でピークに達する
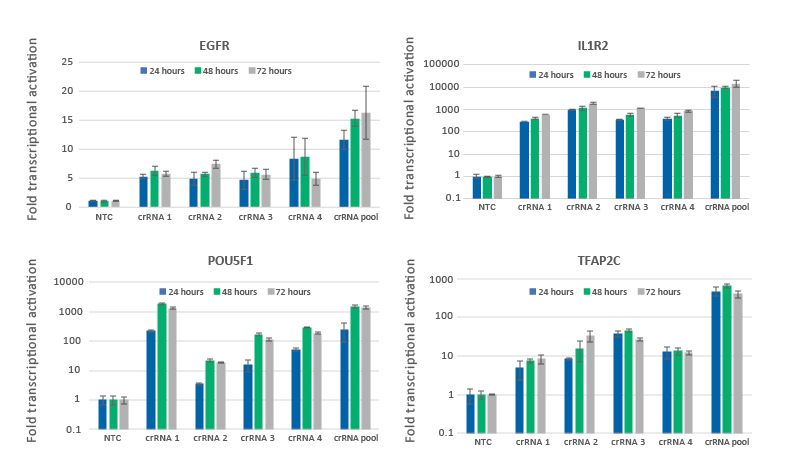
dCas9-VPRを安定的に発現するU2OS細胞を10,000細胞/ウェルでプレーティングし、DharmaFECT 4 Transfection Reagentを用いて、EGFR、IL1R2、POU5F1またはTFAP2Cを標的とするCRISPRa化学合成 crRNA:tracrRNAをトランスフェクションしました。4つのCRISPRaガイドを個別に、またはプールして(合計25 nMの濃度で)使用しました。トランスフェクション後24時間、48時間、72時間に細胞を回収し、RT-qPCRを用いて相対的な遺伝子発現を測定した。各遺伝子の相対的な発現は、GAPDHを対照遺伝子としてCq法で算出し、non-targetingに正規化しました。
CRISPRa crRNAとプールは25nMの作用濃度で高い効果を発揮する
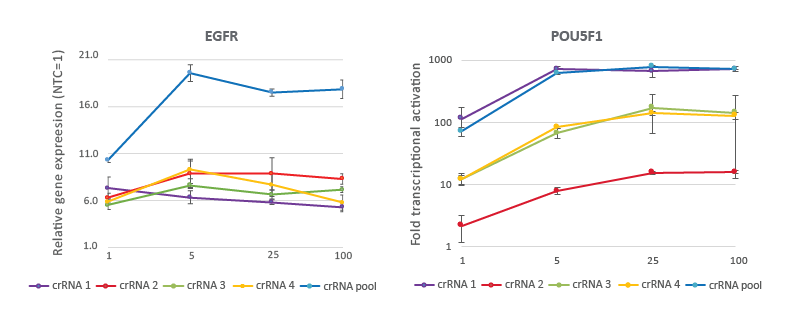
2つの異なる遺伝子を標的としたCRISPRaの用量曲線は、25 nMの作業濃度が強固な標的遺伝子の活性化を達成することを実証しています。dCas9-VPRを安定的に発現するU2OS細胞を10,000細胞/ウェルでプレーティングし、DharmaFECT 4 Transfection Reagentを用いて、EGFRまたはPOU5F1を標的とするCRISPRa化学合成crRNA:tracrRNAをトランスフェクトしました。デザイン済みのcrRNAは、4つの濃度(1、5、25、100 nM)で個別に、またはプールして使用しました。トランスフェクション後72時間で細胞を回収し、RT-qPCRを用いて相対的な遺伝子発現を算出しました。各遺伝子の相対的な発現は、GAPDHを対照遺伝子としてCq法で算出し、non-targetingに正規化しました。
- Horlbeck MA, Gilbert LA, et. al., Compact and highly active next-generation libraries for CRISPR-mediated gene repression and activation. 2016 Sep 23;5. pii: e19760. doi: 10.7554/eLife.19760. PubMed 27661255.
-
Chavez A, Scheiman J et. al., Highly efficient Cas9-mediated transcriptional programming Nat Methods. 2015 Mar 2. doi: 10.1038/nmeth.3312. 10.1038/nmeth.3312 PubMed 2573049.
-
Tanenbaum ME, Gilbert LA, et. al., A protein tagging system for signal amplification in gene expression and fluorescence imaging. Cell. 2014;159(3):635-646. doi:10.1016/j.cell.2014.09.039. PubMed 25307933
