CRISPR-Cas9ゲノム編集に必要なコンポーネントおよびガイドRNAの化学合成
化学合成sgRNAの配列構造
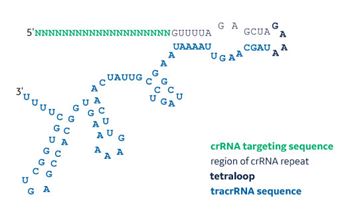 CRISPR-Cas9システムは、哺乳動物、魚類、植物などのゲノムにおいて、機能的タンパク質ノックアウトのためのゲノム編集を迅速に行うことを可能にし、その結果、生物学的研究を劇的に変化させました。天然のStreptoccocus pyogenes CRISPR-Cas9システムには3つのコンポーネントが必要です。すなわち、1)Cas9ヌクレアーゼ、2)ターゲティング配列とリピート配列からなるCRISPR RNA(crRNA)、3)抗リピート配列を介してcrRNAにハイブリダイズするtracrRNAです。crRNA:tracrRNA複合体はCas9ヌクレアーゼをリクルートし、プロトスペーサー隣接モチーフ(protospacer-adjacent motif: PAM)の上流でDNAを切断します。crRNAとtracrRNAは、ループ配列で連結し、キメラシングルガイドRNAを作製することができます(sgRNA; Hsu et al. 2013)。sgRNAは、DNAベースの発現または化学合成によって生成することができます。特許取得済みのDharmaconの2'-ACEケミストリー(Scaringe et al. 1998, Scaringe et al. 2004)を用いることで、より速いカップリング速度、より高い収率、より高い純度で長いRNAを日常的に合成することができ、化学合成sgRNAの生成に理想的です。
CRISPR-Cas9システムは、哺乳動物、魚類、植物などのゲノムにおいて、機能的タンパク質ノックアウトのためのゲノム編集を迅速に行うことを可能にし、その結果、生物学的研究を劇的に変化させました。天然のStreptoccocus pyogenes CRISPR-Cas9システムには3つのコンポーネントが必要です。すなわち、1)Cas9ヌクレアーゼ、2)ターゲティング配列とリピート配列からなるCRISPR RNA(crRNA)、3)抗リピート配列を介してcrRNAにハイブリダイズするtracrRNAです。crRNA:tracrRNA複合体はCas9ヌクレアーゼをリクルートし、プロトスペーサー隣接モチーフ(protospacer-adjacent motif: PAM)の上流でDNAを切断します。crRNAとtracrRNAは、ループ配列で連結し、キメラシングルガイドRNAを作製することができます(sgRNA; Hsu et al. 2013)。sgRNAは、DNAベースの発現または化学合成によって生成することができます。特許取得済みのDharmaconの2'-ACEケミストリー(Scaringe et al. 1998, Scaringe et al. 2004)を用いることで、より速いカップリング速度、より高い収率、より高い純度で長いRNAを日常的に合成することができ、化学合成sgRNAの生成に理想的です。
ゲノム編集における化学合成sgRNAの利点
化学合成の2つのRNA(crRNA:tracrRNA)を組み合わせたシステムは、ほとんどの用途において効率的でコスト効率が高いですが、in vivoおよびex vivoモデルを扱う研究者は、sgRNAシステムを好む傾向があります。プラスミド発現または in vitro 転写 sgRNA と比較して、化学合成 sgRNA を使用する利点は以下の通りです:
- 単一オリゴヌクレオチドで、ready-to-use試薬
- クローニング、シークエンシング、in vitro 転写が不要
- Cas9 mRNAまたはCas9タンパク質と組み合わせた場合、完全にDNA-freeのゲノム編集実験が可能
- 化学修飾の組み込みが可能
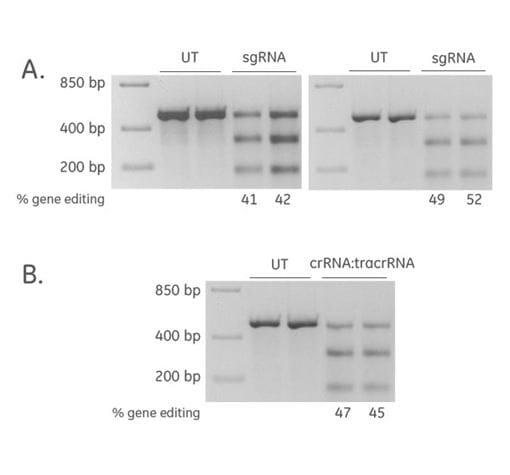
2'-ACEケミストリーを用いて、PPIBを標的とするsgRNA(Hsu et al. 2013, Briner et al. 2014)を化学合成し、HPLCで精製しました。CAGプロモーターからCas9ヌクレアーゼを安定的に発現しているU2OS細胞株を、トランスフェクションの前日に96ウェルフォーマットに1ウェル当たり10,000細胞でプレーティングしました。sgRNA(25 nM)または化学合成crRNA:tracrRNA(25 nM)を、DharmaFECT™ 3トランスフェクション試薬(0.25 μL/ウェル)を用いて重複ウェルにトランスフェクトしました。72時間後、PPIB遺伝子上の標的部位を囲むプライマーを用いて直接細胞溶解を増幅し、ミスマッチ検出アッセイを用いてゲノム編集効率を推定しました(Dharmacon™ Edit-R™ guide rna control kits via T7EI assay - Protocol)。標的ゲノム編集用の化学合成sgRNAは高い編集効率を示しました。
A:2回の実験によるデータ、B:化学合成crRNA:tracrRNAでも高い編集効率が得られました。
References
- Briner, A.E., Donohoue, P.D., et al. , Guide RNA functional modules direct Cas9 activity and orthogonality. Mol Cell. 56(2), 333-339 (2014).
- Hsu, P.D., Scott, D.A., et al., DNA targeting specificity of RNA-guided Cas9 nucleases. Nat. Biotechnol. 31(9), 827-832 (2013).
- Hendel, A, et. al. Chemically modified guide RNAs enhance CRISPR-Cas genome editing in human primary cells. Nat.Biotechnol. 33, 985-989 (2015).
- Scaringe, S.A. et al., Novel RNA synthesis method using 5´-silyl-2´-orthoester protecting groups. J. Am. Chem. Soc. 120:11820-11821 (1998).
- Scaringe, S.A. et al., Preparation of 5´-silyl-2´-orthoester ribonucleosides for use in oligoribonucleotide synthesis. Curr. Protoc. Nuc. Acid Chem. 2.10.1-2.10.16 (2004).
Order products
Cas9ヌクレアーゼ
強固なCas9発現を確実にするために、お客様の細胞タイプに最適なプロモーターを設定する、またはDNA-freeのオプションから選択できます。
CRISPRコントロールと検出プライマー
CRISPR-Cas9ゲノム編集実験の評価には適切なコントロールが不可欠です。
CRISPRデザインツール
チューブまたは96ウェルプレートでカスタム化学合成sgRNAをデザインし、ご注文いただけます。
Edit-R CRISPR化学合成sgRNA
アルゴリズムにより設計された合成sgRNAは、目的の遺伝子を編集し、正確で効率的な遺伝子ノックアウトを保証します。
Helpful Resources
ポスター
2'-ACE化学を用いた長鎖の高度に修飾されたRNAの化学合成
ビデオ:Edit-R CRISPR-Cas9 遺伝子工学プラットフォーム
CRISPR遺伝子ノックアウトのワークフロー、細胞タイプ、実験目的に適した製品の選択方法をご紹介します。このビデオでは、実験に最適なコンポーネントを選択するためのいくつかのハイレベルな質問について説明します。
