- Products
- 遺伝子改変細胞株
- 遺伝子改変済みHAP1細胞株
遺伝子改変済みHAP1細胞株
多くのアカデミア、バイオテック、製薬企業で信頼されている、7,500種類のアイソジェニック遺伝子改変済み細胞株バンク
標的の同定/検証、抗体検証など、あらゆるアプリケーションに適した細胞モデルを約2~4週間でお届けします。
遺伝子改変済みHAP1細胞株
1Start Here
2Choose
遺伝子改変済みHAP1細胞株の利点
- 生物学的コンテクストにおけるご研究の遺伝子の特徴を、手頃に特徴づけることができます。仮説検証モデル、副次的検証モデルとしてご利用いただけます。
- 必須遺伝子以外のほぼすべてのヒト遺伝子に対してご用意があります。
- 標的遺伝子の編集領域はサンガーシーケンシングで塩基配列が確認されています。
- ほとんどの遺伝子には2つの独立したノックアウト製品があります。複数クローンによる検証を可能にします。
- 目的遺伝子以外は遺伝的に同質(アイソジェニック)なHAP1親細胞株とのペアで提供されます。親細胞株は、実験のコントロールとなり、他の要因に影響されずに目的遺伝子の役割を研究することを可能にします。
実績のあるノックアウトモデル

私共のHAP1ヒトノックアウト細胞は、抗体の検証と初期の薬物発見研究のためのゴールドスタンダードのリソースになりました。2021年にはHorizonはCiteAbにより「2020年に最も多く引用されたノックアウト細胞株またはライセートサプライヤー」として認められました。
この賞の詳細については、こちらをご覧ください。
なぜHAP1細胞はゲノム編集細胞株モデルとして理想的なオプションなのか?
私共の遺伝子改変済みHAP1細胞株は、1つの対立遺伝子だけを変異させれば遺伝子の機能を喪失させることができる細胞株と、CRISPR-Cas9テクノロジーという2つの優れたテクノロジーの相乗効果によるものです。HAP1細胞株は、慢性骨髄性白血病(CML)細胞株KBM-7に由来する一倍体に近いヒト細胞株です。KBM-7細胞は男性患者に由来し、Y染色体を欠いており、一倍体HAP1細胞のX染色体は1本です。HAP1細胞株の作製方法の詳細、および遺伝子型の詳細については、Referencesタブを参照してください。
そのほかのHAP1細胞株の特性
- 単一細胞希釈による増殖維持が可能
- トランスフェクションが容易
- 迅速な倍加時間
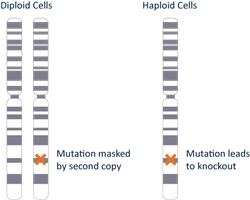
一般的に使用される細胞株の多くは二倍体であるか、特定の対立遺伝子のコピーが2つ以上あります。ゲノム編集を行って遺伝子の機能を喪失させる際には、すべての対立遺伝子について機能喪失の変異を導入しなければ表現型が現れません。HAP1細胞株には、各遺伝子のコピーが1つだけであるという利点があります。つまり、1つの対立遺伝子だけを変異させれば、それ以外の対立遺伝子によってマスクされないようにすることができます。このことにより、HAP1細胞は、遺伝子の機能または表現型解析のための確立されたツールとして使われています。
HAP1細胞は継代すると、時間の経過とともに自発的に二倍体化します。ただし、二倍体状態を引き起こすのは編集された対立遺伝子の複製であるため、ノックアウトは二倍体化の影響を受けません。
HAP1細胞株は、DNA損傷修復経路およびストレス応答などの広範囲の生物学的プロセス、疾患モデリングならびに抗体検証などにおいて利用されてきました。HAP1細胞株論文リストは2019年の査読済み論文をアプリケーション別に分類しています。
限定使用ラベルライセンス
Horizon Discoveryの細胞株をご購入の際は、細胞株の限定使用ラベルライセンス(LULL: LIMITED USE LABEL LICENSE AGREEMENT)へのご同意が必要です。
HAP1細胞およびがん関連細胞のカタログ細胞株は、皆様のご研究に役立ち、ご研究を促進するための理想的な研究ツールであると確信しています。
しかしながら、HAP1細胞およびがん関連細胞のカタログ細胞株の性能にご満足いただけない場合は、テクニカルサポートまでご連絡ください。当社の製品に適用される販売条件に詳述されていますように、お客様と共に問題解決に真摯に取り組みます。
References
For more information about how the HAP1 cell line was generated, see:
- Kotecki, M., Reddy, P. S. & Cochran, B. Isolation and Characterization of a Near-Haploid Human Cell Line. Experimental Cell Research 252, 273–280 (1999). DOI: 10.1006/excr.1999.4656
- Carette, J. E. et al. Haploid Genetic Screens in Human Cells Identify Host Factors Used by Pathogens. Science 326, 1231–1235 (2009). DOI: 10.1126/science.1178955
- Carette, J. E. et al. Ebola virus entry requires the cholesterol transporter Niemann–Pick C1. Nature 477, 340–343 (2011). DOI: 10.1038/nature10348
- Essletzbichler, P. et al. Megabase-scale deletion using CRISPR/Cas9 to generate a fully haploid human cell line. Genome Res 24, 2059–2065 (2014). DOI: 10.1101/gr.177220.114
- Dong, M. et al. DAG1 mutations associated with asymptomatic hyperCKemia and hypoglycosylation of α-dystroglycan. Neurology 84, 273–279 (2015). DOI: 10.1212/WNL.0000000000001162
- Kravtsova-Ivantsiv, Y. et al. KPC1-mediated ubiquitination and proteasomal processing of NF-κB1 p105 to p50 restricts tumor growth. Cell 161, 333–347 (2015). DOI: 10.1016/j.cell.2015.03.001
- Lackner, D. H. et al. A generic strategy for CRISPR-Cas9-mediated gene tagging. Nat Commun 6, 10237 (2015). DOI: 10.1038/ncomms10237
