ヒト初代細胞におけるゲノム編集の展望は、不死化細胞株以上に遺伝子機能の研究を可能にし、免疫療法応用の発見を後押ししています。ただし、CRISPR-Cas9によるゲノム編集は、多くの初代ヒト細胞タイプで非常に困難です。病原体に対する応答、自己炎症性疾患、およびがん/悪性腫瘍に重要な役割を果たすヒト骨髄性細胞に適用した場合、これまでゲノム編集は特に非効率的でした。
カリフォルニア大学サンフランシスコ校、グラッドストーン研究所のAlex Marson, MD, PhDと Nevan Krogan, PhDの研究室は、Horizon DiscoveryのEdit-R™化学合成ガイドを用いて、その機能と分化能を維持しながら単球の遺伝子を編集するプロトコールを開発しました。研究室では、Cas9リボ核タンパク質(RNP:ribonucleoprotein)複合体を使用して、ゲノム編集効率、細胞形態、および細胞生存のバランスが取れたヌクレオフェクション条件の最適化に着手しました。これを達成するには、機器のパラメーターを微調整するとともに、新規の細胞の分化および培養方法の開発が必要でした。
著者らは、初代ヒトCD14 +単球にCas9-RNP複合体として導入したHorizon SAMHD1化学合成ガイドRNAが、その後分化した単球由来マクロファージ(MDM)または単球由来樹状細胞(MDDC)で持続する堅牢なSAMHD1遺伝子ノックアウトをもたらすことを示しています。さらに、SAMHD1関連抗ウイルス因子機能の劇的な除去は、このプラットフォームが貪食能や細胞型特異的マーカー遺伝子の発現などの機能的および表現型の評価に適していることを明確に示しています。
Cell Reportsの出版物の図のスナップショットを以下にご紹介します。
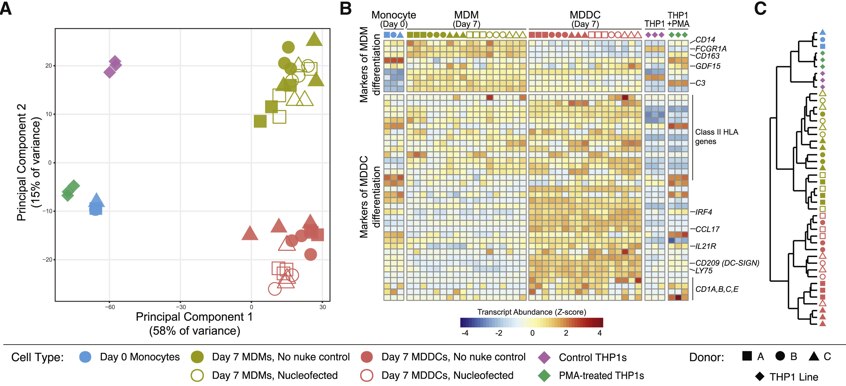
Figure 2. CRISPR-Cas9を介した遺伝子ノックアウトは、標的とする骨髄由来細胞における分化と機能の重要な側面を保持します。
(A)示された細胞タイプからのRNAシーケンシング(RNA-seq)の主成分分析
(B)MDMまたはMDDC分化の選択されたマーカーの正規化された転写産物量(Zスコア)(Lehtonen et al., 2007)
(C)ユークリッド距離による(B)のデータの階層的クラスタリングの樹状図
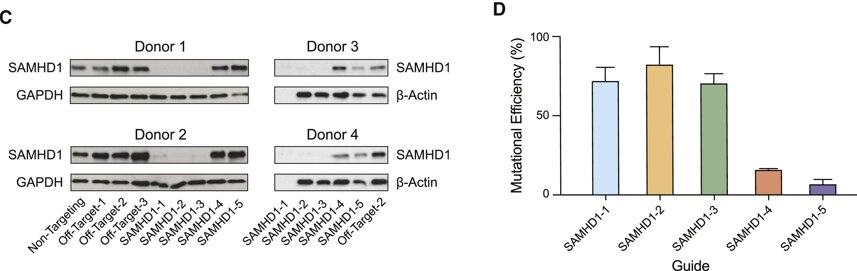
Figure 3. HIV-1宿主制限因子の機能評価のための、同質遺伝子単球由来マクロファージの作製
(CおよびD)イムノブロッティング(C)およびシーケンシング(D)によるSAMHD1ノックアウトの定量化。ドナー3および4のガイドSAMHD1-1に利用できるタンパク質サンプルはありませんでした。サンガーシーケンシングは、TIDEによって変異効率について分析されました。棒グラフのエラーバーは、少なくとも3つの生物学的反復の平均±SDを表します。
この新しい方法論は、初代ヒト単球の研究を可能にする重要なステップであり、強力なノックアウトと機能的および表現型の調査を可能にします。これらの細胞のゲノム編集を実行する能力は、新しい免疫療法への扉を開き、骨髄由来細胞ベースの免疫腫瘍療法の開発を加速する可能性があります。
Written by Ashleigh Keller
 Ashleighは2020年1月にホライゾンディスカバリーのScientist IとしてR&Dチームに加わりました。彼女は、CRISPRゲノム編集ツール、遺伝子転写活性化/抑制試薬であるCRISPRaおよびCRISPRiなどのCRISPRmodポートフォリオの開発と応用に携わっています。Ashleighはコロラド州立大学で理学士号を取得し、現在フロリダ大学で微生物学と生化学の修士号を取得しています。
Ashleighは2020年1月にホライゾンディスカバリーのScientist IとしてR&Dチームに加わりました。彼女は、CRISPRゲノム編集ツール、遺伝子転写活性化/抑制試薬であるCRISPRaおよびCRISPRiなどのCRISPRmodポートフォリオの開発と応用に携わっています。Ashleighはコロラド州立大学で理学士号を取得し、現在フロリダ大学で微生物学と生化学の修士号を取得しています。
Cell Reportsの論文全文はこちらから
Efficient generation of isogenic primary human myeloid cells using CRISPR-Cas9 ribonucleoproteins Hiatt, J., et al. Cell Reports. 35:6 109105. https://doi.org/10.1016/j.celrep.2021.109105
