CRISPRテクノロジーにより、遺伝子と分子経路をより明確に調べることができるようになりました。ノックアウト細胞株を、遺伝子レスキューと疾患変異の複製とともに、または独立した細胞モデルとして使用して、研究を検証し、発見を拡張する方法を検討します。
遺伝子の役割に現在利用可能な豊富な遺伝情報を翻訳し、基本的な生物学を理解し、病気の病因を理解するための突然変異の役割にリンクすることには、重大な課題があります。
ノックアウト(KO)細胞株は、これを行うための優れたモデルシステムです。細胞株の主な利点は、遺伝子編集を使用して同質遺伝子の細胞株ペアを構築できることです。ここでは、変異型モデルを野生型コントロールと一緒に調べることができます。
KO Cell Linesを使用して研究を最大限に活用する方法の5つの優れた例を次に示します。
- 抗体などの研究ツールの検証
- パスウェイの主要なプレーヤーの同定
- 薬理効果の確認
- 適切なコントロールを設定することによる研究クオリティの向上
例:遺伝子レスキューおよび疾患モデルとして使用する - 疾患関連変異と病態の関連性
抗体の検証
使用する研究ツールの品質は、研究結果の品質に大きく影響します。抗体はライフサイエンスで最も一般的に使用されている試薬の1つですが、広く使用されているにもかかわらず、この非常に貴重な生物学的ツールを使用前に検証する方法に関する標準的なガイドラインはありません。
たとえば、特性が不十分な抗体は非特異的な結果をもたらす可能性があり、抗体の製造ロットのみが異なる場合でも再現性に難がある場合があります。しかしながら、抗体検証の基準は上昇しており、ノックアウト細胞株を使用したアプリケーション固有の検証を示す業界標準が求められています。
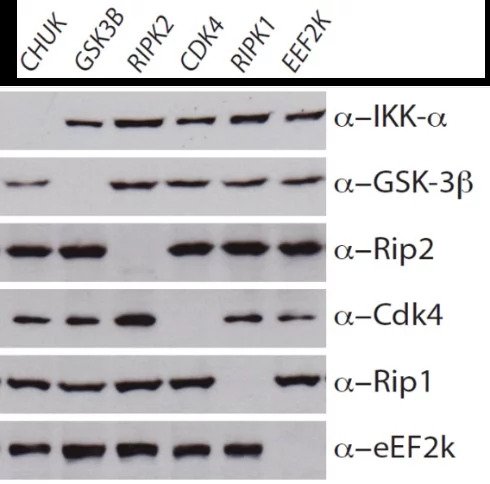
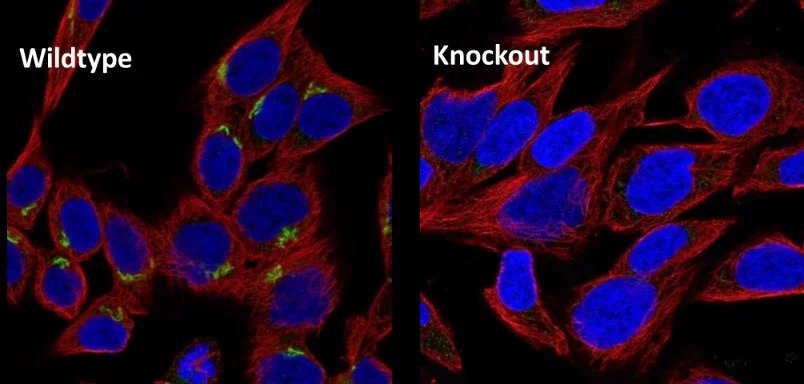
この例は、遺伝子ノックアウト細胞株セレクションのデータです。ウエスタンブロットデータはタンパク質の欠失を示し、使用された抗体を検証しています。同様に、免疫蛍光染色画像では、緑色の染色がないことから、使用した抗体の特異性を検証しています。野生型とノックアウト細胞株を並行して使用することで、研究用試薬の品質を管理するための貴重なツールが提供されることを示しています。
オフターゲット効果に配慮したパスウェイ解析
多くの場合、パスウェイには、関連するが別個の分子とプロセスが複数存在します。遺伝子改変された細胞株は、目的の遺伝子または変異の役割を研究するための確立されたツールです。
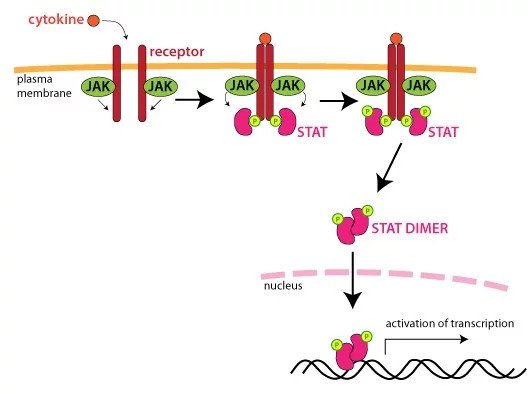
JAK1は特定のサイトカインのシグナル伝達に不可欠であり、腫瘍の転移に関与すると考えられています。INFγ受容体と機能的および物理的に関連していることが知られています。リガンドが結合すると、受容体に関連するJAKが活性化され、細胞質から特定のSTAT(シグナル伝達物質および転写活性化因子)が動員されます。
これらのSTATはJAKの基質になります。活性化されたSTATは受容体からリリースされ、受容体は核に移行して特定のエンハンサー分子に結合します。これらはその後、ターゲット遺伝子の発現に影響を及ぼします。
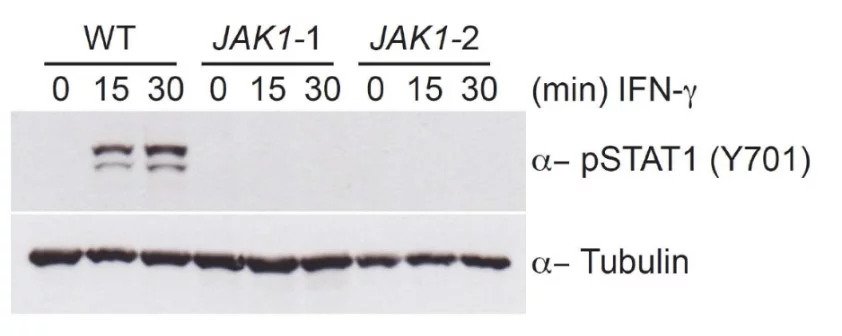 STATのリン酸化におけるJAK1の役割は、このケースでは、JAK1遺伝子にフレームシフト変異を導入したHAP1細胞株で確認できます。これらのノックアウト細胞株は、このウエスタンブロットに見られるように、STATのリン酸化が認められません。
STATのリン酸化におけるJAK1の役割は、このケースでは、JAK1遺伝子にフレームシフト変異を導入したHAP1細胞株で確認できます。これらのノックアウト細胞株は、このウエスタンブロットに見られるように、STATのリン酸化が認められません。
CRISPR-Cas9で操作された細胞株でのオフターゲット編集の影響を軽減するには、2つの異なるsgRNAによって作成されたノックアウト細胞株クローンを使用することが有用です。オフターゲット編集が発生した場合、それは異なる場所で見られます。したがって2つの細胞株クローンに共通する表現型は、ターゲット遺伝子のみの変異によるものであると確信できます。この実験では、2つの別々のHAP1クローンを使用してこれらの所見を確認しました。これは、これがオフターゲット効果ではなかったことを示しています。
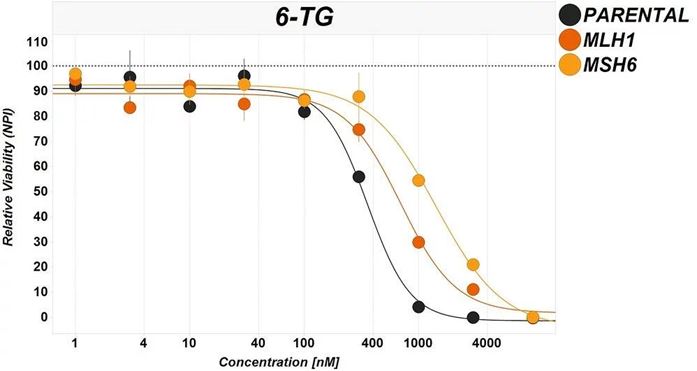
薬理学的干渉は、一般的にパスウェイ解析のために使用されます。この例では、化学療法剤の6-チオグアニン(6-TG)を使用して、DNA損傷応答の影響を調べています。ゲノムの完全性を維持するために、細胞にはさまざまな種類の損傷にそれぞれ固有の無数のメカニズムが備わっています。これらのDNA損傷応答パスウェイの効率は、薬理学的効果と細胞障害性を引き起こす治療法の有効性の確認において重要な役割を果たします。
6-TGは成長阻害性代謝拮抗剤であり、効果を発揮するには活性型DNAミスマッチ修復(MMR)システムが必要です。重要なタンパク質を欠くノックアウト細胞株は、6-TGの標的を確認するために使用されました。
ここでは、MLH1またはMSH6のノックアウト細胞株は、6-TGの細胞障害性効果に対する抵抗性を生じさせたため、MLH1またはMSH6のMMRパスウェイへの関与が示唆されました。完全な実験と結果の詳細は、このブログで確認できます。
遺伝子レスキューモデルおよび疾患モデル
患者集団でその疾患で重要な変異を同定した後、次のステップは、疾患の表現型における、または治療への反応をもたらす生物学的メカニズムを探索することです。
ノックアウト細胞株は、単純な分子生物学技術と組み合わせることで、次のことが可能になります。
- 目的の遺伝子をレスキューして表現型を復元する
- ノックアウト細胞株に、患者集団で観察される点突然変異などの機能的変異改変を行う
この例には、RFWD3と呼ばれるE3リガーゼの役割が含まれます。E3ユビキチンリガーゼは、DNA損傷修復、特に相同組換え(HR: homologous recombination)に役割を果たすことが知られています。BRCA1はHRに重要なE3リガーゼをコードしており、BRCA1タンパク質の欠陥はしばしば乳がんを引き起こします。
高田らのグループのこの例では、DNA損傷修復におけるRFWD3の役割を明らかにするための鍵は、その特定のE3リガーゼの機能が完全に喪失したシステムを入手し、重複する可能性のある分子からその特定の役割を分離することでした。HAP1ノックアウト細胞株は、これを達成するために使用された単純なツールです。
これは、HAP1親細胞株、RFWD3ノックアウトHAP1細胞株、または患者集団で同定された2つのRFWD3変異の1つを発現するようにレンチウイルスで安定的に形質導入されたRFWD3ノックアウトHAP1細胞株の生存曲線です。
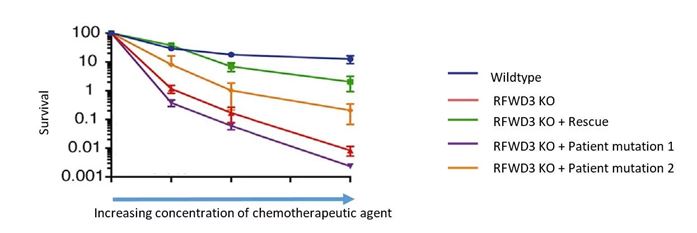
RFWD3ノックアウトHAP1細胞株はMMC(マイトマイシンC)に対して過感受性を示しましたが、野生型RFWD3をKOモデルに再導入するとMMC感受性が減少しました。ただし、ノックアウトモデルへの疾患関連点変異の導入は別個の感受性応答を示しました。 1つの変異は部分的なレスキューを示していますが、別の点変異(RINGフィンガードメイン変異体-C315A)はレスキューを示していません。
疾患関連変異と病態の関連性
結果は、SWI / SNFクロマチンリモデラーの主要コンポーネントを含む特定のクロマチンレギュレーターが、ドセタキセルの高レスポンダーと低レスポンダーを容易に区別することを示しています。 60種類の多様なヒト癌細胞株のデータセットを調べることにより、SWI / SNF成分の発現がドセタキセル感受性と逆相関することが示されました。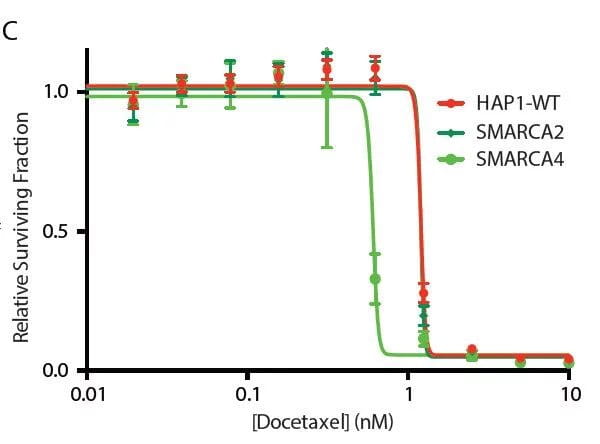
これらの発見の検証は、遺伝子ノックアウト HAP1細胞株を使用することによって可能であり、モデル細胞株におけるSWI / SNFサブユニットBRG1 (SMARCA4)の喪失が、ドセタキセル感受性の増強につながることを示しています。
結果は、野生型と比較して、SMARCA4ノックアウトHAP1細胞株におけるドセタキセルのIC50の1/4の減少を示しています。これらの発見は、薬物反応のバイオマーカーとしてのクロマチン調節因子、ならびにドセタキセルに対して患者を反応性にし、薬物抵抗性と戦うための治療標的を示しています。
まとめ
遺伝子ノックアウト HAP1細胞株は、基本的な生物学を理解するのに役立つだけでなく、疾患病因の変異の役割を特定するための多目的なツールです。最終的に、これは疾患の治療と患者の予後予測の進歩につながりました。
Horizonには、研究を向上させるための幅広い遺伝子ノックアウト細胞株があります。
Order Horizon HAP1 KO cell lines
Learn more
- Is your antibody binding the right target? – Featured article
- HAP1 cell lines - are they the right cell model for you? – Blog article
- Frequently asked questions for HAP1 knockout cell lines – Blog article
