- CRISPRa (CRISPR activation) 試薬
- dCas9-VPR mRNA
CRISPRmod CRISPRa dCas9-VPR mRNA
dCas9-VPR発現のための’DNA-free’オプション
遺伝子転写活性化のための化学合成CRISPRa crRNAとのコトランスフェクションまたはエレクトロポレーション用の精製dCas9-VPRmRNAです。
大容量サイズの価格についてはお問い合わせください。

CRISPRa dCas9-VPR mRNAは、3つの転写活性化因子(VP64、p65、およびRta)と2つの核局在化シグナル(NLS)に融合した、ヒト用にコドンを至適化したヌクレアーゼ不活性化Cas9遺伝子を発現します。プロモーター領域または転写開始部位(TSS: transcriptional start site)の上流の遺伝子配列を標的とする適切に設計されたガイドRNAと組み合わせると、遺伝子のネイティブ転写開始部位(TSS: transcriptional start site)が活性化されます。
Schematic diagram of CRISPRmod CRISPRa dCas9-VPR mRNA. Modular representation of translation start sequence (TSS), co-expression enrichment options (none, enhanced Green Fluorescent Protein [eGFP], or puromycin resistance (Puro), dCas9-VPR and polyadenine tail (PolyA).
テクノロジーの概要は、CRISPRaアプリケーションのページをご確認ください。
ハイライト
- dCas9-VPR安定発現細胞株を作製する必要はありません。
- DharmaFECT Duoトランスフェクション試薬を使用してCRISPRa化学合成crRNA:tracrRNA とdCas9-VPR mRNAをコトランスフェクトするか、細胞にコエレクトロポレートすることができます。
- 簡便な濃縮オプション:GFPまたはピューロマイシン耐性の共発現を選択できます。(サポートデータを参照)。
- mRNAは‘translation-ready’であるため、最適なプロモーター選択は不要です。
dCas9-VPR mRNAおよび化学合成ガイドRNAのエレクトロポレーションによるCRISPRa遺伝子の活性化
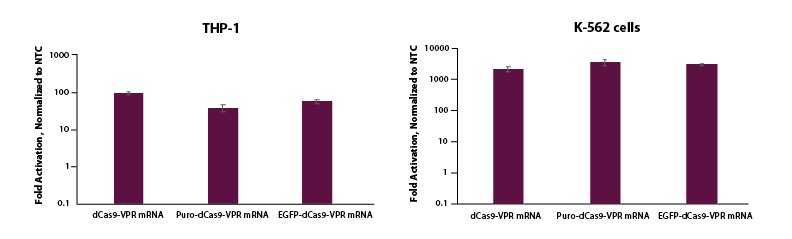
THP-1およびK-562細胞に、Lonza 2bシステムを使用して、dCas9-VPR mRNA(5 µg, Cat # CAS12024)、Puro dCas9-VPR mRNA(5 ug, Cat # CAS12026)、またはEGFP dCas9-VPR mRNA(5 µg, Cat # CAS12025)のいずれかと、化学合成tracrRNA(25 nM, Cat # U-002005-05)、およびTTNを標的とるするプールフォーマットのCRISPRa crRNA(5 uM, Cat # P-005395-01-0005)またはnon-targetingコントロール(NTC, 25 nM, Cat # U-009500-10-05)をエレクトロポレーションしました。トランスフェクションの48時間後に細胞を回収し、全RNAを単離しました。 相対的な遺伝子発現は、RT-qPCRを使用して測定しました。各遺伝子の相対的発現は、ハウスキーピング遺伝子としてGAPDHを使用するCq法で計算し、non-targetingコントロールに対して正規化しました。
FACSを使用して、EGFP dCas9-VPR mRNAを含む細胞を選択し、遺伝子転写活性化を強化することができる
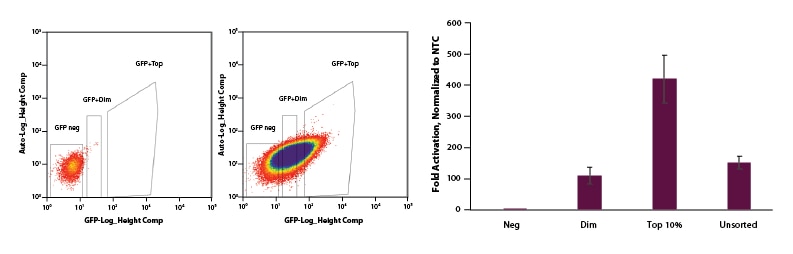
U2OS細胞を透明な6ウェルプレートにウェルあたり200,000細胞で播種しました。24時間後、細胞にCRISPRa EGFP dCas9-VPR mRNA(2 µg, Cat # CAS12025)、化学合成tracrRNA(25 nM, Cat # U-002005-05)、およびIL1R2を標的とするプールフォーマットCRISPRa crRNA(25 nM, Cat # P-007960-01-0005)またはnon-targetingコントロール(NTC、25 nM, Cat # U-009500-10-05)を、DharmaFECT Duo(2 µg /ウェル, Cat # T-2010-01)を使用してコトランスフェクトしました。トランスフェクションの24時間後に、細胞をトリプシン処理し、FACSを実行し、細胞をNegative、Dim、Top 10%の3つのカテゴリーに分類しました。細胞を6ウェルディッシュに再播種し、回復させました。24時間後、全RNAを単離し、RT-qPCRを使用して相対的な遺伝子発現を測定しました。各遺伝子の相対的発現は、ハウスキーピング遺伝子としてGAPDHを使用するCq法で計算し、non-targetingコントロールに対して正規化しました。ソーティングされた細胞のNegative集団は、活性化を示していません。Dimとソーティングをしなかった集団は、約120倍の活性化を示し、Top 10%の集団は450倍の活性化を示しました。
ピューロマイシンは、Puro dCas9-VPR mRNAを含む細胞を選択し、遺伝子転写活性化を強化するために使用できる

U2OS細胞を透明な6ウェルプレートにウェルあたり200,000細胞で播種しました。24時間後、細胞にPuro dCas9-VPR mRNA(2 µg, Cat # CAS12026)、化学合成tracrRNA(25 nM, Cat # U-002005-05)、およびPOU5F1(25 nM, Cat # P-019591-01-0005)、IL1R2(25 nM, Cat # P-007960-01-0005)、TFAP2C(25 nM, Cat # P-005238-01-0005)、TTN(25 nM, カタログ番号:P -005395-01-0005)を標的とするCRISPRa化学合成crRNAまたはnon-targetingコントロール(NTC, 25 nM, Cat # U-009500-10-05)を、DharmaFECT Duoを使用してコトランスフェクトしました。トランスフェクションの24時間後に、2 µg/mlのピューロマイシン増殖培地を細胞に添加し、もう一方のプレートに通常の増殖培地を添加しました。トランスフェクションの48時間後にクリスタルバイオレットアッセイを実施し、画像キャプチャをし、生存率と全RNAを評価しました。相対的な遺伝子発現は、RT-qPCRを使用して測定しました。各遺伝子の相対的発現は、ハウスキーピング遺伝子としてGAPDHを使用するCq法で計算し、non-targetingコントロールに対して正規化しました。テストしたすべての遺伝子について、選択処理をしていないサンプルと比較した場合、活性化の3〜5倍の濃縮が観察されました。
Efficient gene activation with dCas9-VPR mRNA and target sgRNA
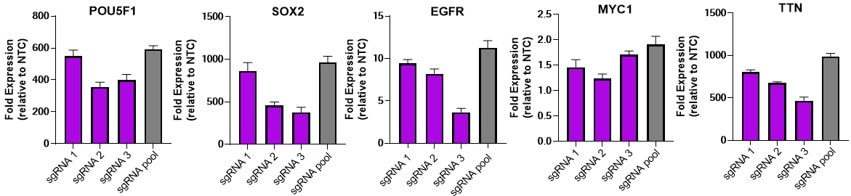
U2OS were plated at 10,000 cells/well and transfected using DharmaFECT Duo (0.15uL/well) Transfection Reagent with 25nM individual or pooled CRISPRa synthetic single guide RNA (sgRNA) targeting POU5F1, SOX2, EGFR, MYC1 or TTN and 200 ng / well of CRISPRmod CRISPRa dCas9-VPR mRNA. Cells were harvested at 72 hours post-transfection and gene expression was assessed using RT-qPCR. Relative fold transcriptional activation for each gene was calculated with the Cq method using beta-actin as the housekeeping gene and normalized to an experiment using non-targeting control sgRNA.

