- CRISPRa (CRISPR activation) 試薬
- CRISPRmod CRISPRa synthetic crRNA(化学合成crRNA)
CRISPRmod CRISPRa synthetic crRNA(化学合成crRNA)
CRISPR activationを使用したヒトおよびマウス遺伝子の過剰発現のためのデザイン済み化学合成ガイドRNA。4種類のcrRNAの混合物(プール)または個別の試薬が利用可能です

CRISPRmod CRISPRa synthetic crRNA(化学合成crRNA)
1Start Here
2Choose
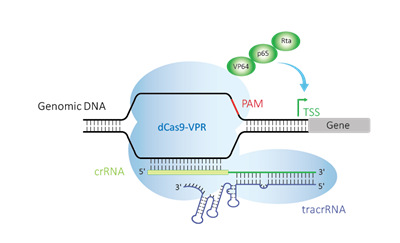
使いやすい化学合成試薬による内在性遺伝子活性化
CRISPR activation(CRISPRa)システムは、1つ以上の遺伝子転写活性化因子に融合した触媒活性が不活化されたCas9(dCas9)を利用するもので、古典的なCRISPR-Cas9ゲノム編集システムをユニークに改変したものです。プロモーター領域または転写開始部位(TSS: transcriptional start site)の上流の遺伝子配列を標的とする、適切に設計されたガイドRNAと組み合わせて使用すると、転写活性化を促進します。
テクノロジーの概要は、CRISPRaアプリケーションのページをご確認ください。
CRISPRa crRNA試薬のハイライト
- 配列デザインの異なる4種類のcrRNAの混合物(プール)または個別の試薬として利用可能で、非常に効果的な転写活性化を提供します(サポートデータを参照)。
- Horlbeckらによって公開されたアルゴリズム2に基づいた設計です。最適化された設計による強力なレベルの遺伝子転写活性化を示しています(参考文献を参照)。
- 化学的に修飾されたcrRNAは、ヌクレアーゼ分解に対する安定性を高め、全体的なパフォーマンスを向上させます。
- 異なる転写開始部位を持つ遺伝子については、別個のガイドRNAデザインが利用可能です(P2とラベル付けされています)。
化学合成crRNAを用いたCRISPRa遺伝子転写活性化実験に必要な試薬:
- dCas9-VPR3用のレンチウイルス発現用プラスミド、レンチウイルス粒子またはmRNA。dCas9-VPRは哺乳動物用にコドンを至適化したStreptococcus pyogenes由来dCas9にVPRを融合しています。SunTagテクノロジー4とも互換性があります。
- 化学合成tracrRNA(trans-activating CRISPR RNA)
- 標的遺伝子に対するデザイン済みCRISPRa crRNA
CRISPRa crRNAおよびtracrRNAの注文数量ガイドライン
この表は、プールフォーマットまたは個別のcrRNAのいずれかを用いて、推奨されるcrRNA:tracrRNA作業濃度(25 nM:25 nM)で、さまざまなプレート/ウェル形式でリピッドトランスフェクション法を実施できる概算の実験数を示しています。計算では、ピペッティングエラーは考慮されていません。
| crRNA nmol | tracrRNA nmol | 96-well plate 100 µL volume | 24-well plate 500 µL volume | 12-well plate 1000 µL volume | 6-well plate 2500 µL volume |
|---|---|---|---|---|---|
| 2 | 2 | 800 | 160 | 80 | 32 |
| 5 | 5 | 2000 | 400 | 200 | 80 |
| 10 | 10 | 4000 | 800 | 400 | 160 |
| 20 | 20 | 8000 | 1600 | 800 | 300 |
dCas9-VPR安定発現細胞を用いたCRISPRaワークフロー
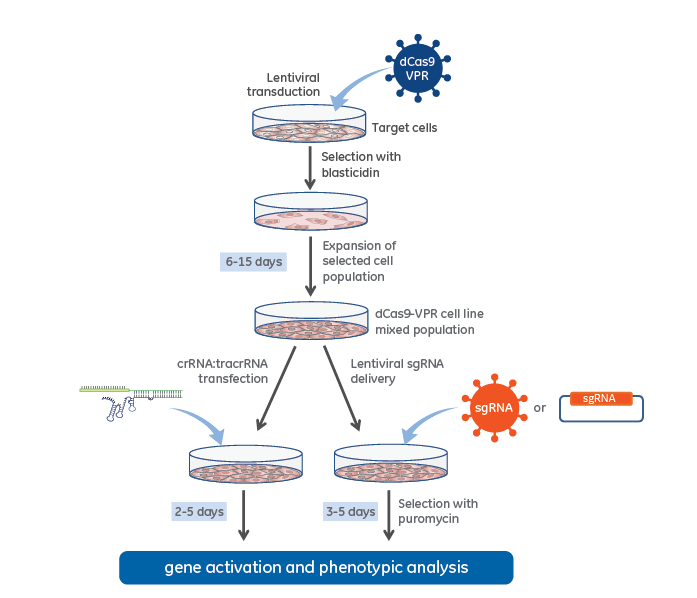
レンチウイルスdCas9-VPRと化学合成crRNA:tracrRNA(左)、またはレンチウイルス発現sgRNA(右)を使用したCRISPR activationワークフロー
CRISPRaコントロール
CRISPRa synthetic crRNA ポジティブコントロール
- 十分に特徴付けられた遺伝子を標的とするCRISPRa化学合成crRNAは、最適な実験条件の評価のために使用します。
CRISPRa synthetic crRNA non-targetingコントロール
- Non-targeting controlsコントロールは、遺伝子標的特異的crRNAの非存在下でCRISPRaに対するベースライン細胞応答を評価するために使用します。
CRISPRa関連製品
化学合成tracrRNA
- tracrRNA(Trans-activating CRISPR RNA)は、HPLC精製された化学合成長鎖RNA です。dCas9-VPRによる遺伝子転写活性化を実現するためのガイド複合体を形成するためにcrRNAとともに使用します。ヌクレアーゼ分解に対する耐性のために改変されています。
CRISPRa dCas9-VPR
- 転写活性化因子に融合したヌクレアーゼ不活性化Cas9を発現するレンチウイルス粒子、精製プラスミド、またはmRNAがあります。ガイドRNAと複合体を形成すると、内在性遺伝子の発現が引き起こされます。
複数のdCas9-VPR安定発現細胞株における化学合成crRNA:tracrRNAによる効率的な遺伝子活性化
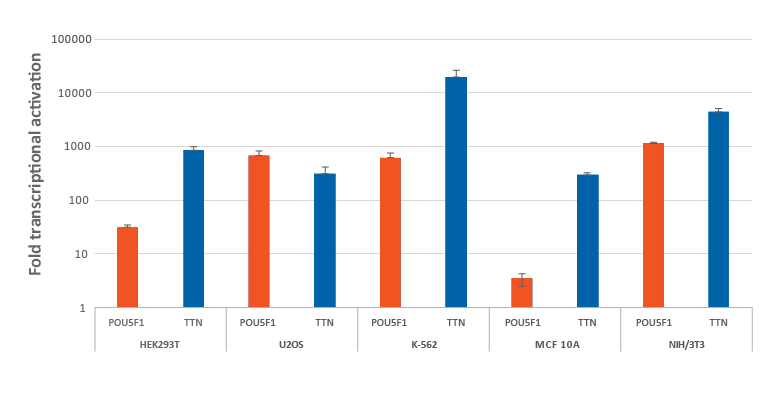
CRISPRa dCas9-VPRを安定発現するように改変されたHEK293T、U2OS、MCF 10A、NIH/3T3を10,000細胞/ウェルでプレーティングし、DharmaFECTトランスフェクション試薬を使用して、POU5F1およびTTNを標的とするCRISPRa 化学合成crRNA:racrRNA(25 nM)をトランスフェクトしました。K562細胞には、POU5F1およびTTNを標的とするCRISPRa 化学合成crRNA:tracrRNA(400 nM)をエレクトロポレーションしました。トランスフェクションの72時間後に細胞を回収し、RT-qPCRを使用して相対的な遺伝子発現を測定しました。各遺伝子の相対的な転写活性化倍率は、ハウスキーピング遺伝子としてGAPDHを使用するCq法で計算し、non-targetingコントロールに対して正規化しました。
CRISPRa 化学合成crRNAの混合物(プール)は転写活性化を高める
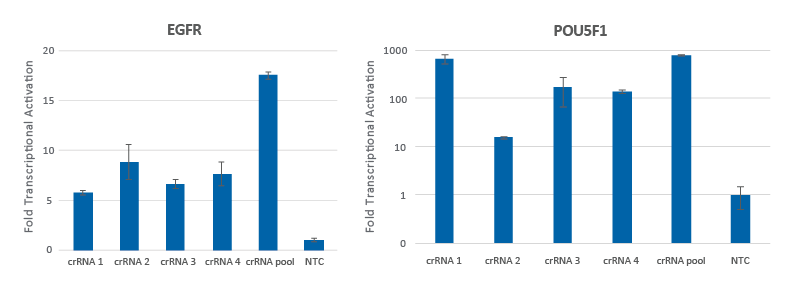
個別のCRISPRa crRNAは、それ自体でも強力な標的遺伝子の活性化を実現しますが、単一の試薬に一緒にプールすると、転写活性化レベルをより強くできます。CRISPRa dCas9-VPRを安定発現するように改変されたU2OS細胞を10,000細胞/ウェルでプレーティングし、DharmaFECT 4トランスフェクション試薬を使用してEGFRまたはPOU5F1を標的とするCRISPRa 化学合成crRNA:tracrRNAをトランスフェクトしました。4つのCRISPRaデザイン済みcrRNAは、個別またはプールフォーマットで使用しました(合計濃度:25 nM)。トランスフェクションの72時間後に細胞を回収し、RT-qPCRを使用して相対的な遺伝子発現を測定しました。各遺伝子の相対的な転写活性化倍率は、ハウスキーピング遺伝子としてGAPDHを使用するCq法で計算し、non-targetingコントロール(NTC)に対して正規化しました。
CRISPRaによる転写活性化倍率は内在性遺伝子発現レベルに依存する
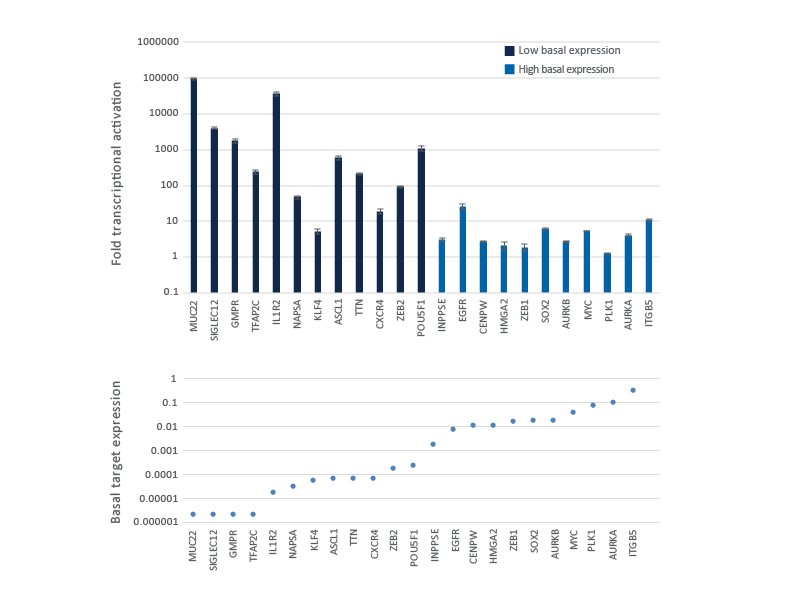
基礎発現が低いかまったくない遺伝子は、強力なレベルまで活性化するのが簡単ですが、すでに高レベルで発現している遺伝子は、さらに過剰発現するのがより困難です。dCas9-VPR安定発現U2OS細胞を10,000細胞/ウェルでプレーティングし、DharmaFECT 4トランスフェクション試薬を使用して、異なる基礎発現レベルの23種類の遺伝子を標的とするCRISPRa 化学合成crRNA:tracrRNAプール(25 nM)をトランスフェクトしました。トランスフェクションから72時間後に細胞を回収し、相対的な遺伝子発現を、RT-qPCRを使用して測定しました。CRISPRaを介した転写活性化の倍数は上のグラフに示しました。ここでは、NTCコントロールで処理されたサンプルにおける基本的な転写産物の発現レベルが低いものから高いものへと遺伝子が並べられています。下のグラフには、GAPDHコントロールと比較した標的遺伝子の基礎発現を示しています。
蛍光抗体分析は、化学合成crRNAを使用した効果的なCRISPRa遺伝子の活性化を示す
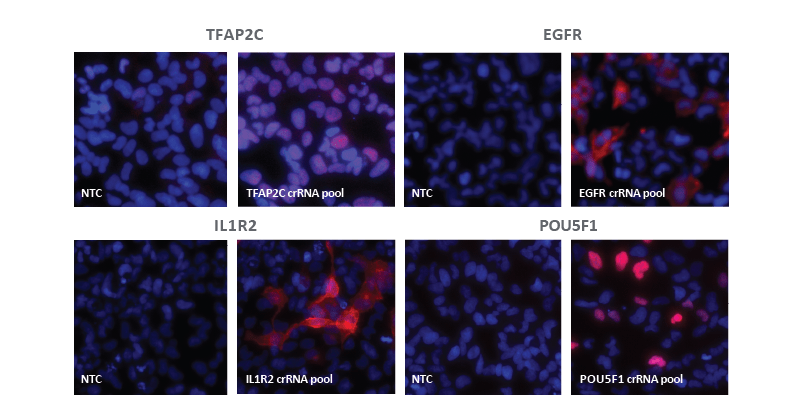
dCas9-VPR安定発U2OS細胞を10,000細胞/ウェルでプレーティングし、DharmaFECT 4トランスフェクション試薬(0.2 µL/ウェル)を使用して、TFAP2C、EGFR、IL1R2、POU5F1をターゲットとするCRISPRa化学合成crRNA:tracrRNAプール(総濃度25 nM)またはNTCコントロールをトランスフェクトしました。トランスフェクションの72時間後、細胞を4%パラホルムアルデヒドで固定し、0.5% Triton X-100で透過処理した後、ターゲット特異的一次抗体およびDylight 550標識二次抗体とインキュベートしました。核はHoescht33342で染色しています。標的特異的なCRISPRa crRNAプールフォーマットまたはNTCコントロールで処理された細胞について、蛍光画像を重ね合わせて示しています。
U2OS細胞におけるCRISPRaによる遺伝子の転写活性化は24時間で観察され、48〜72時間でピークに達する
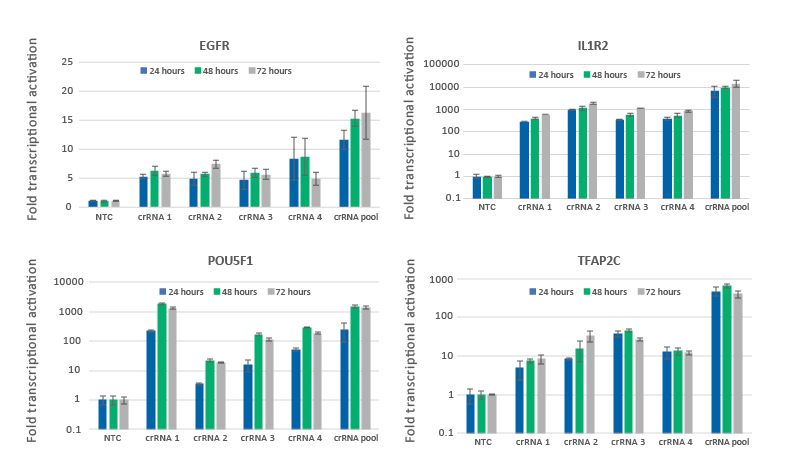
dCas9-VPR安定発現U2OS細胞を10,000細胞/ウェルでプレーティングし、DharmaFECT 4トランスフェクション試薬を使用して、EGFR、IL1R2、POU5F1、またはTFAP2Cを標的とするCRISPRa化学合成crRNA:tracrRNAをトランスフェクトしました。4つのCRISPRaデザイン済みcrRNAは、個別またはプールフォーマットで使用しました(合計濃度:25 nM)。トランスフェクションの24、48、72時間後に細胞を回収し、RT-qPCRを使用して相対的な遺伝子発現を測定しました。各遺伝子の相対的発現は、ハウスキーピング遺伝子としてGAPDHを使用するCq法で計算し、non-targetingコントロールに対して正規化しました。
CRISPRa用量曲線は、25 nMの作業濃度で非常に効果的な遺伝子活性化を示す
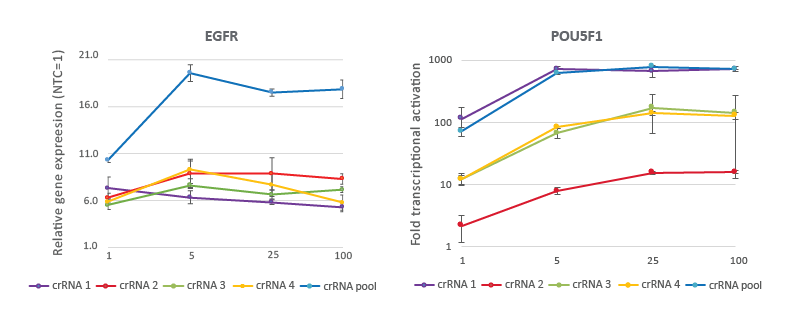
dCas9-VPR安定発現U2OS細胞を10,000細胞/ウェルでプレーティングし、DharmaFECT 4トランスフェクション試薬を使用して、EGFRまたはPOU5F1を標的とするCRISPRa化学合成crRNA:tracrRNAをトランスフェクトしました。デザイン済みcrRNAは、個別、または4つの濃度(1、5、25、100 nM)のプールフォーマットで使用しました。トランスフェクションの72時間後に細胞を回収し、RT-qPCRを使用して相対的な遺伝子発現を計算しました。各遺伝子の相対的発現は、ハウスキーピング遺伝子としてGAPDHを使用するCq法で計算し、non-targetingコントロールに対して正規化しました。
- Strezoska, Z., Dickerson, SM, et. al., CRISPR-mediated transcriptional activation with synthetic guide RNA. J Biotechnol. 2020 Aug 10;319:25-35. doi: 10.1016/j.jbiotec.2020.05.005. PubMed 32470463
-
Horlbeck MA, Gilbert LA, et. al., Compact and highly active next-generation libraries for CRISPR-mediated gene repression and activation. 2016 Sep 23;5. pii: e19760. doi: 10.7554/eLife.19760. PubMed 27661255
-
Chavez A, Scheiman J et. al., Highly efficient Cas9-mediated transcriptional programming. Nat Methods. 2015 Mar 2. doi: 10.1038/nmeth.3312. 10.1038/nmeth.3312 PubMed 25730490
-
Tanenbaum ME, Gilbert LA, et. al., A protein tagging system for signal amplification in gene expression and fluorescence imaging. Cell. 2014;159(3):635-646. doi:10.1016/j.cell.2014.09.039. PubMed 25307933
Application notes
Posters
Protocols
Quick protocols
Safety data sheets
Related Products
標的遺伝子特異的crRNAの非存在下でCRISPRaコンポーネントに対するベースライン細胞応答を評価するためのnon-targetingコントロール
遺伝子転写活性化のための化学合成CRISPRa crRNAとのコトランスフェクションまたはエレクトロポレーション用の精製dCas9-VPRmRNA
