レンチウイルス粒子をパッケージングする際、時々受ける質問があります:自然組み換えが起こっていないこと、あるいは細胞への形質導入後に複製能を持つレトロウイルス(replication-competent retrovirus: RCR)が形成されていないことを、どのように確認すればよいのでしょうか?
これは、レンチウイルスベクターを使用する際の生物学的安全性に関わる非常に重要な問題です。特に、レンチウイルスベクターは哺乳動物のゲノムに組み込まれ、癌関連疾患を引き起こす可能性があることが知られているからです (1,2)。RCRを発生させるリスクを減らすために、レンチウイルスプラスミドとパッケージングシステムの設計にはいくつかの戦略が用いられました。第一に、レンチウイルスゲノムの必須要素のみを含むように、トランスファーベクターを最小化する。さらに、自己不活性化レンチウイルス粒子を作製するために、保持されたウイルス領域をさらに改変しました(例:3'LTR領域)。さらなるバイオセーフティ機能がパッケージングシステムに適用されました。すなわち、gag-proウイルスのパッケージング構成要素は複数のプラスミドに分割され、構成要素間の相同性は厳密に分析され、回避されており、自然組み換えの確率を最小にします。また、パッケージングプラスミドは、ウイルスの子孫を生産するのに必要なタンパク質のトランス発現を可能にしますが、これらのベクターはLTRやψパッケージングシグナルを含まないため、新しい複製コンピテントウイルスを生産することはできません (3-6)。
形質導入された細胞の上清中のRCRの存在を調べるには、FDAの推奨に従うのが最善です (7)。これには形質導入後の上清の少なくとも5%を採取し、それを寛容な細胞株に適用することが含まれます。その後、RCRの増幅をコロニー形成アッセイで検出することができます。これを行うには、クリスタルバイオレットのプロトコールが役に立ちます。RCRによるコロニーは、下の図に示すように、目視で確認できるはずです。
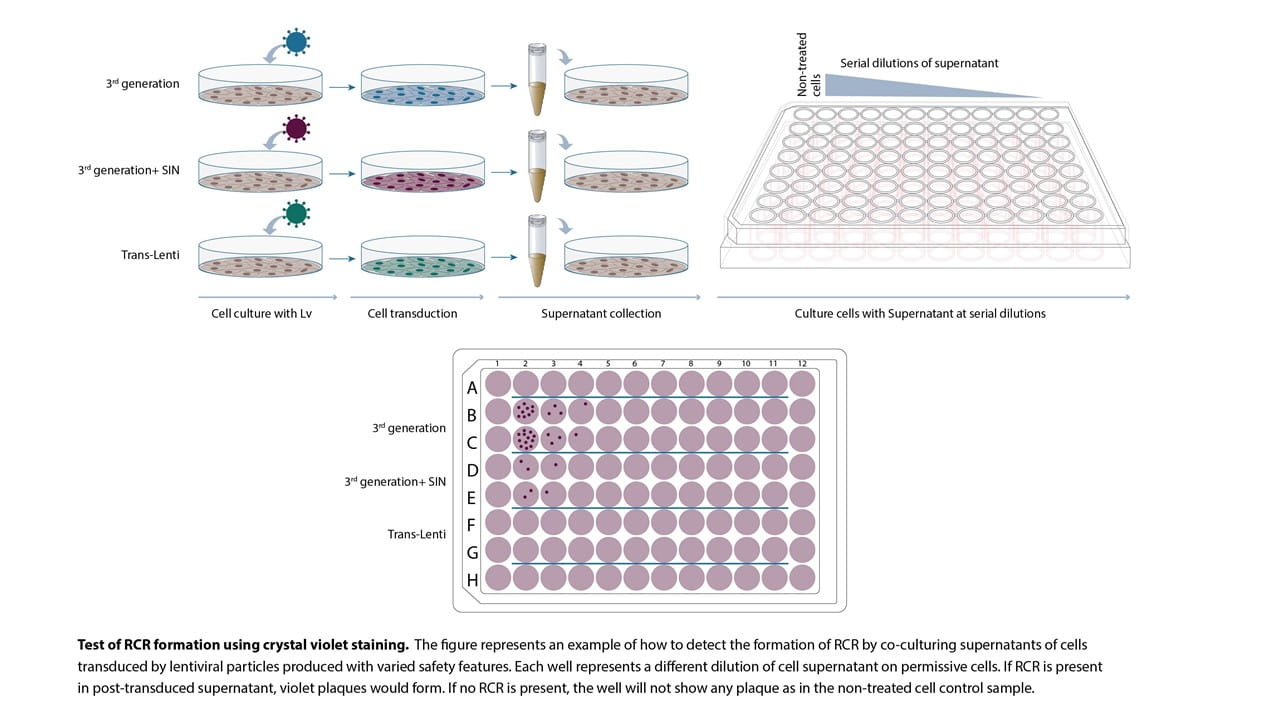
新しいRCRの形成を検出する別の方法として、qPCRによる測定があります。組み換えRCRにはウイルス成分と細胞成分が混在している可能性があり、またRCRの増殖が遅いのか速いのかかも不明であるため、この方法は多くの課題を抱えています。提案されている一つの選択肢は、ほとんどのパッケージング系に存在するVSV-G遺伝子をqPCRで測定することです (8)。この方法にはqPCR条件の最適化と技術の検出限界の確立が必要ですが、RCRの形成をより迅速に判定する方法としてFDAも認めている方法です。
要約すると、レンチウイルスベクターを使用する場合(特に遺伝子治療アプリケーションに使用する場合)、自然組み換えを避ける必要があり、意図しないウイルス複製が起こらないようにする必要があります。レンチウイルスベクターを使用する際の信頼性を高める一つの方法は、当社のTrans-Lentiviral Packaging Systemsのような第4世代の製品のような、最先端の安全機能を備えたパッケージングミックスを使用することです。さらに、上記の投稿で述べたように、RCR形成の可能性が非常に低いことを示すいくつかの研究 (9, 10)を通して、RCR/L粒子の形成を調査することが望まれるかもしれません。
 Written by: Ivonne Rubio, Ph.D. | Scientific Support Specialist 3
Written by: Ivonne Rubio, Ph.D. | Scientific Support Specialist 3
Ivonne has been part of the scientific support team since August 2013. With several years of hands-on experience in the lab and a broad scientific background, she loves assisting customers with their scientific questions-- especially about different strategies in gene modulation or CRISPR based studies.
Resources
レンチウイルスパッケージングの安全性に関する基本的な情報 - Featured article
レンチウイルスベクター製品の安全性に関する追加情報 - 製品安全性シート
Associated products
Edit-R デザイン済みAll-in-one Lentiviral sgRNA
References
1. Donahue R.E., et al. Helper virus induced T cell lymphoma in nonhuman primates after retroviral mediated gene transfer. J. Exp. Med. 176:1125–1135 (1992)
2. Cornetta K., et al. Infection of human cells with murine amphotropic replication-competent retroviruses. Hum. Gene Ther. 4:579–588. (1993)
3. Naldini, L. et al., In Vivo Gene Delivery and Stable Transduction of Nondividing Cells by a Lentiviral Vector. Science 272, 263–267 (1996).
4. Wu, X. et al., Development of a Novel Trans-Lentiviral Vector That Affords Predictable Safety. Molecular Therapy 2, 47–55 (2000).
5. Kappes J.C., Wu X, Safety considerations in vector development. Somat Cell Mol Genet 26, 147-58 (2001).
6. Kappes J.C. et al, Production of trans-lentiviral vector with predictable safety. Methods Mol Med 76, 449-65 (2003).
7. FDA recommendations: https://www.fda.gov/media/113790/download
8. Skrdlan, L. et al., Detection of Replication Competent Lentivirus Using a qPCR Assay for VSV-G. Mol Ther Methods Clin Dev. 16; 8: 1–7 (2018).
9. Marcucci., K. Retroviral and Lentiviral Safety Analysis of Gene-Modified T Cell Products and Infused HIV and Oncology Patients. Mol Ther. 26(1): 269–279. (2018)
10. Cornetta, K., et al. Screening Clinical Cell Products for Replication Competent Retrovirus: The National Gene Vector Biorepository Experience. Mol Ther Methods Clin Dev. 10: 371–378 (2018).
