CRISPRmod CRISPRi synthetic sgRNA(化学合成sgRNA)non-targetingコントロール
遺伝子転写抑制実験の評価のための検証済みの化学合成CRISPRiプールフォーマットまたは個別のsgRNA
標的遺伝子特異的sgRNAの非存在下でCRISPRiコンポーネントに対するベースライン細胞応答を評価するために使用します。

遺伝子転写抑制実験の評価のための検証済みの化学合成CRISPRiプールフォーマットまたは個別のsgRNA

CRISPRi synthetic sgRNA(化学合成sgRNA)non-targetingコントロールは、CRISPRi sgRNAを使用した遺伝子転写抑制実験のネガティブコントロールとして使用するために設計され、推奨されています。これらのnon-targetingコントロールは、dCas9-SALL1-SDS3と結合して複合体を形成しますが、ヒトゲノム内のPAM隣接部位を標的としません。ネガティブコントロールで処理された細胞で観察された遺伝子発現レベルまたは生存率の変化は、標的特異的CRISPRi化学合成sgRNAで処理された細胞と比較するためのCRISPRiコンポーネントに対する細胞のベースライン応答として使用できます。
non-targetingコントロールに加えて、CRISPRi化学合成ポジティブコントロールを使用して、効率的な遺伝子転写抑制のための実験条件を最適化することをお勧めします。
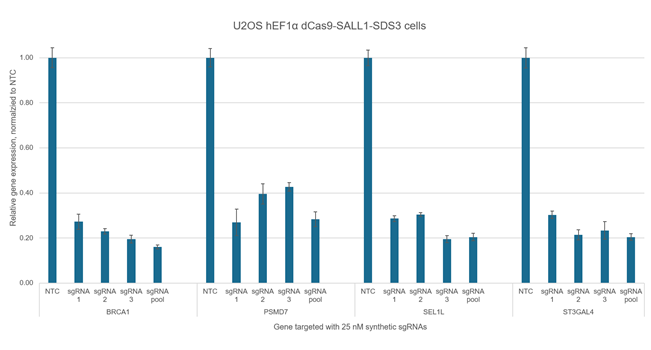
個別のCRISPRmod CRISPRi sgRNAは、独立して強力な標的遺伝子抑制を達成しますが、プールすると抑制レベルが向上します。dCas9-SALL1-SDS3を安定して発現するU2OS細胞を10,000細胞/ウェルでプレーティングし、DharmaFECT 4トランスフェクション試薬を使用して、BRCA1、PSMD7、SEL1L、またはST3GAL4を標的とする化学合成sgRNAをトランスフェクトしました。デザイン済みsgRNAは、個別に使用、またはプールフォーマットを使用しました(合計濃度:25 nM)。トランスフェクションの72時間後に細胞を回収し、全RNAを単離し、RT-qPCRを使用して相対的な遺伝子発現を測定しました。各遺伝子の相対的発現は、ハウスキーピング遺伝子としてGAPDHを用いた∆∆ Cq法で計算し、non-targetingコントロール(NTC)に対して正規化しました。
