- CRISPRi (CRISPR interference) 試薬
- dCas9-SALL1-SDS3 mRNA
CRISPRmod CRISPRi dCas9-SALL1-SDS3 mRNA
dCas9-SALL1-SDS3発現のためのレンチウイルスフリーオプション
化学合成CRISPRi sgRNAとのコトランスフェクションまたはエレクトロポレーション用の精製されたdCas9-SALL1-SDS3 mRNAであり、標的遺伝子の転写抑制のために使用します。

CRISPRi dCas9-SALL1-SDS3 mRNAは、ヌクレアーゼ不活性化S. pyogenes Cas9遺伝子のヒトコドン最適化バージョンを発現し、独自の転写リプレッサー(SALL1およびSDS3)に融合しています。ネイティブの転写開始部位の近くの遺伝子を標的とする適切に設計されたガイドRNAと組み合わせると、発現が抑制されます。

テクノロジーの概要はCRISPRi アプリケーションのページをご確認ください。
CRISPRi dCas9-SALL1-SDS3mRNAのハイライト
- 安定したdCas9-SALL1-SDS3発現細胞株の作製不要
- DharmaFECT Duoトランスフェクション試薬を使用してCRISPRi synthetic sgRNA(化学合成sgRNA)とdCas9-SALL1-SDS3mRNAをコトランスフェクトするか、細胞にコエレクトロポレートするシンプルな手順
- EGFPまたはピューロマイシン耐性の共発現により、FACSまたは抗生物質の選択を使用したトランスフェクションの最適化、または細胞濃縮が容易
- mRNAはready for translationであるため、最適なプロモーター選択の必要はありません。
dCas9-SALL1-SDS3 mRNAを使用したCRISPRi実験に必要な試薬
- CRISPRi dCas9-SALL1-SDS3 mRNA
- 標的遺伝子に対してデザインしたCRISPRi化学合成sgRNA(ワークフローを参照)
化学合成sgRNAとdCas9-SALL1-SDS3 mRNAを使用したCRISPRiワークフロー
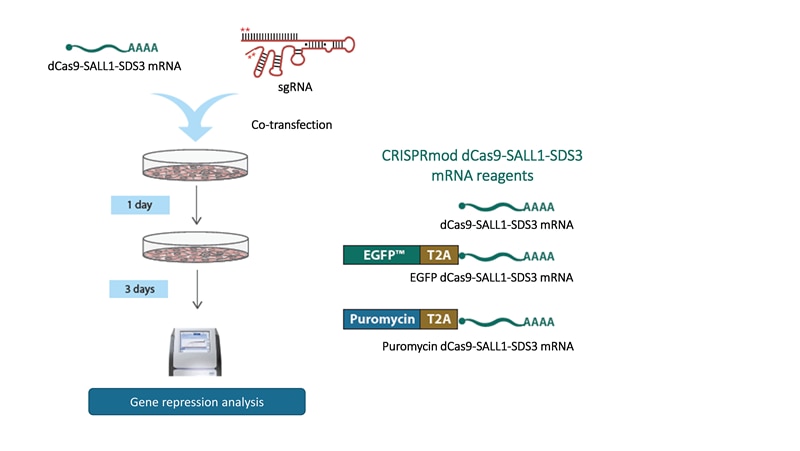
細細胞をCRISPRi化学合成sgRNAおよびCRISPRi dCas9-SALL1-SDS3 mRNAでコトランスフェクトまたはエレクトロポレートします。次に、蛍光またはピューロマイシン耐性オプションを使用して細胞集団を濃縮します。このシステムは、迅速で一過性の遺伝子転写抑制研究に最適です。
dCas9-SALL1-SDS3と化学合成sgRNAによる堅牢な一過性の遺伝子転写抑制

K562およびJurkat細胞に、Lonza 96ウェルシャトルシステムを用いて、dCas9-KRABまたはdCas9-SALL1-SDS3 mRNA(2 µg)、および、PPIBあるいはSEL1LをターゲットとするプールフォーマットCRISPRi synthetic sgRNA(化学合成sgRNA)(5 µM)を導入ました。WTC-11 hiPS細胞に、Lonza 96ウェルシャトルシステムを用いて、dCas9-KRABまたはdCas9-SALL1-SDS3 mRNA(1 µg)、および、PPPIBまたはSEL1LをターゲットとするプールフォーマットCRISPRi synthetic sgRNA(3 µM)を導入しました。72時間後に細胞を回収しました。全RNAを単離し、RT-qPCRを使用して相対的な遺伝子発現を測定しました。各標的遺伝子の相対的な遺伝子発現は、ハウスキーピング遺伝子としてGAPDHを用いた∆∆Cq法で計算し、non-targetingコントロール(NTC)に対して正規化しました。
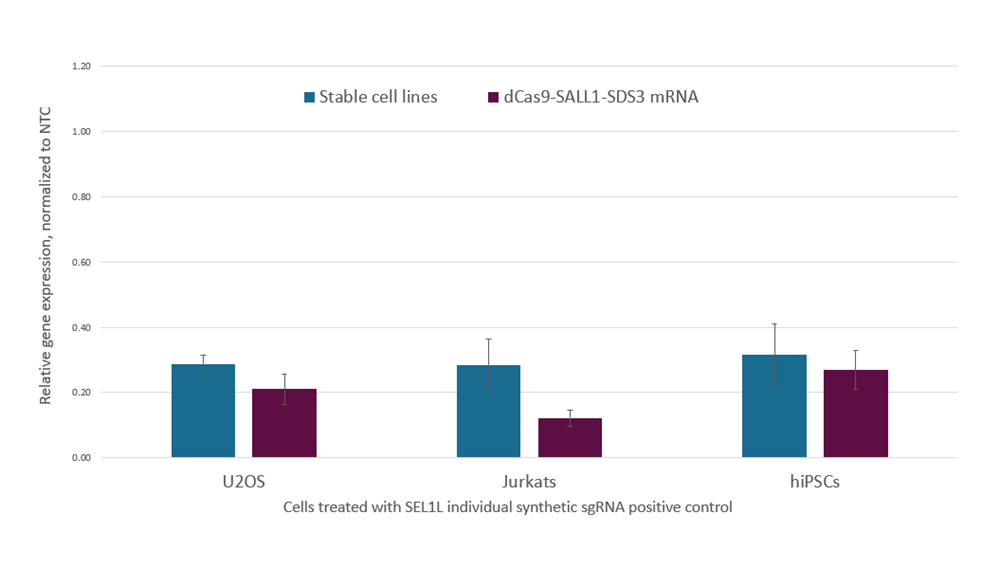
dCas9-SALL1-SDS3 mRNAとCRISPRi化学合成sgRNAの同時トランスフェクションは、安定したdCas9-SALL1-SDS3発現細胞株へのトランスフェクションよりも大きな遺伝子転写抑制をもたらす
データは解析タイミングと導入方法を合わせて、複数の実験から編集されたものです。dCas9-SALL1-SDS3を安定発現するU2OS細胞を10,000細胞/ウェルでプレーティングし、DharmaFECT 4トランスフェクション試薬を使用してSEL1Lを標的とするCRISPRi synthetic sgRNA(化学合成sgRNA)(25 nM)でトランスフェクトし、親U2OS細胞は、10,000細胞/ウェルでプレーティングし、DharmaFECT Duoトランスフェクション試薬を使用して、dCas9-SALL1-SDS3 mRNA(200 ng)およびSEL1Lを標的とするCRISPRi synthetic sgRNA(25 nM)をコトランスフェクトしました。dCas9-SALL1-SDS3を安定発現するJurkat細胞に、SEL1Lを標的とするCRISPRi synthetic sgRNA(5 µM)を導入し、親Jurkats細胞にはdCas9-SALL1-SDS3 mRNA(2 µg)およびSEL1Lを標的とするCRISPRi synthetic sgRNA(5 µM)をLonza 96ウェルシャトルシステムを用いて導入しました。dCas9-SALL1-SDS3を安定発現するWTC-11ヒトiPS細胞にSEL1Lを標的とするCRISPRi synthetic sgRNA(3 µM)を導入し、親のWTC-11hiPS細胞には、dCas9-SALL1-SDS3 mRNA(1 µg)およびSEL1Lを標的とするCRISPRi synthetic sgRNA(3 µM)をLonza 96ウェルシャトルシステムを用いて導入しました。U2OS細胞はトランスフェクションの48時間後に回収し、JurkatおよびhiPS細胞は導入72時間後に回収しました。全RNAを単離し、RT-qPCRを使用して相対的な遺伝子発現を測定しました。SEL1Lの相対的な遺伝子発現は、ハウスキーピング遺伝子としてGAPDHまたはACTBを用いたΔΔCq法で計算し、non-targetingコントロール(NTC)に対して正規化しました。
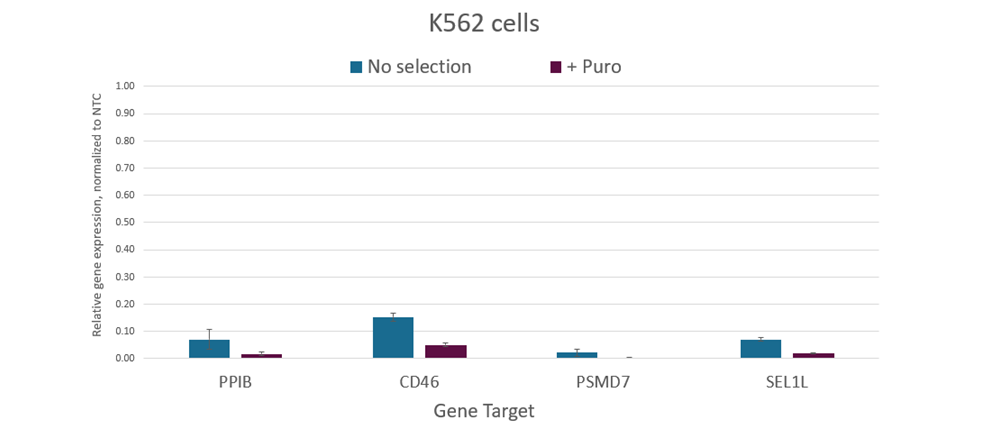
PuroRを共発現するdCas9-SALL1-SDS3mRNAは、ピューロマイシン選択を使用した濃縮を可能にする
K562細胞に、Lonza 96ウェルシャトルシステムを用いて、Puro dCas9-SALL1-SDS3 mRNA(2 µg)および、PPIB、CD46、PSMD7あるいはSEL1LをターゲットとするプールフォーマットのCRISPRi sgRNAを導入しました。導入24時間後に、2 µg/mlのピューロマイシンを含む増殖培地を細胞に添加し、複製プレートに通常の増殖培地を投与しました。ヌクレオフェクションの48時間後に全RNAを単離し、RT-qPCRを使用して相対的な遺伝子発現を測定しました。各標的遺伝子の相対的発現は、ハウスキーピング遺伝子としてGAPDHを用いたΔΔCq法で計算し、non-targeting(NTC)に対して正規化しました。
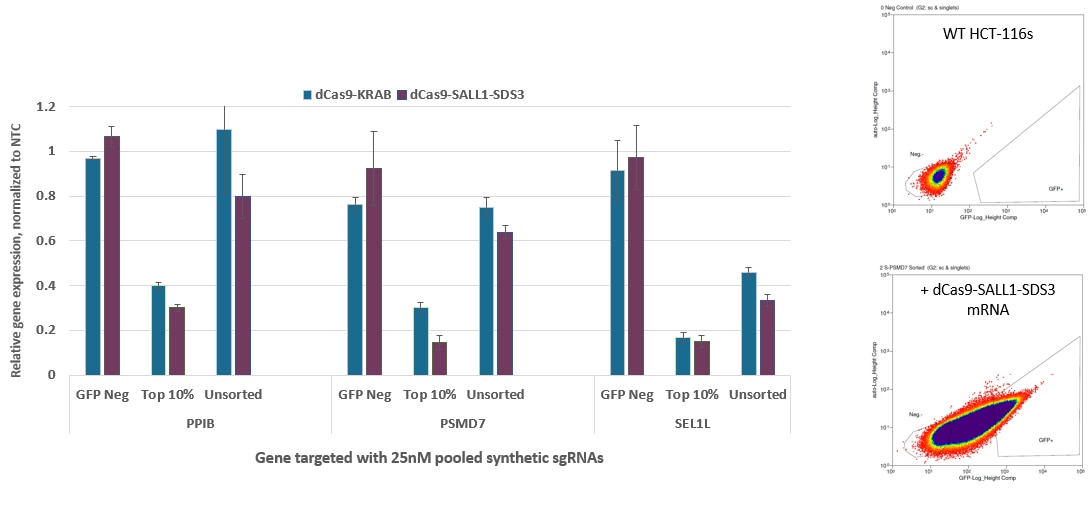
EGFPを共発現するCRISPRi dCas9-SALL1-SDS3 mRNAにより、FACSの濃縮が可能
HCT-116細胞を透明な6ウェルプレートに400,000細胞/ウェルで播種しました。 24時間後、DharmaFECT Duoトランスフェクション試薬を使用して、細胞にEGFP-dCas9-KRABまたはEGFP dCas9-SALL1-SDS3 mRNA(2.5 µg)、および、PPIB、PSMD7、またはSEL1L(25 nM)をターゲットとするプールフォーマットのCRISPRi synthetic sgRNA(化学合成sgRNA)をコトランスフェクトしました。トランスフェクションの24時間後に細胞をトリプシン処理し、FACSで細胞をGFP陰性(GFP Neg)と上位10%GFP発現(上位10%)の2つのカテゴリーに分類しました。選別後、細胞を6ウェルディッシュに再播種し、回復培養しました。回復培養の24時間後に細胞を回収し、全RNAを単離し、RT-qPCRを使用して相対的な遺伝子発現を測定しました。各標的遺伝子の相対的発現は、ハウスキーピング遺伝子としてGAPDHを用いたΔΔCq法で計算し、non-targetingコントロール(NTC)に対して正規化しました。
Protocols
-
CRISPRmod dCas9-VPR or dCas9- SALL1-SDS3 mRNA and synthetic guide RNA transfection protocol
-
Electroporation of CRISPRmod dCas9-VPR or dCas9-SALL1-SDS3 mRNA and synthetic guide RNA for gene modulation
-
Enrichment of transfected cells with CRISPRmod EGFP dCas9-VPR or dCas9-SALL1-SDS3 mRNA
-
哺乳類細胞の抗生物質選択のための用量反応曲線(キルカーブ)プロトコール
Safety data sheets
Technical manuals
Related Products
遺伝子転写抑制実験の評価のための検証済みの化学合成CRISPRiプールフォーマットまたは個別のsgRNA
LentiBOOST transduction enhancer can increase successful viral transduction in challenging to transduce cells, or, complex cellular engineering work; while preserving cell viability and minimizing the amount of viral particles required for your experiment. LentiBOOST technology is actively used in the production of clinical stage lentivirally delivered therapies, including some approved therapies, providing a direct path to therapeutic applicability for your research studies. Tested with Dharmacon Lentiviral reagents.
CRISPRi all-in-one lentiviral ライブラリーの単一のsgRNAベクターを導入することにより、導入ステップを繰り返すことなく転写レベルで数千の遺伝子を抑制しします。