- CRISPRa (CRISPR activation) 試薬
- MS2 tracrRNA
CRISPRa MS2 tracrRNA
SAM転写活性化システムと互換性のある化学合成tracrRNA(trans-activating CRISPR RNA)

SAM(synergistic activation mediator)システムによる遺伝子転写活性化の場合、CRISPRa MS2 tracrRNA(以前の名称はSAM tracrRNA)をCRISPRa化学合成crRNAとともに使用して遺伝子転写活性化研究を行うことができます。MS2 tracrRNAは、最適化された公開済みのS. pyogenes tracrRNA配列に基づいて、化学的に合成され、HPLCで精製された長鎖RNA分子です(Jinek, 2012)。これには、SAMシステムのMS2-p65-HSF1コンポーネントに結合するMS2アプタマー配列も含まれています(Konermann et al., 2015)。
SAMシステムを使用した哺乳動物細胞における遺伝子転写活性化実験に必要な試薬:
- SAM活性化システムにおける2つのコンポーネントを発現する安定細胞株(NLS-dCas9-VP64およびMS2-p65-HSF1)
- CRISPRa MS2 tracrRNA
- 標的遺伝子に対するデザイン済みCRISPRa 化学合成crRNA
crRNAおよびtracrRNAの注文数量ガイドライン
この表は、推奨されるcrRNA:tracrRNA作業濃度(25 nM:25 nM)で、まざまなプレート/ウェル形式でリピッドトランスフェクション法を実施できる概算の実験数を示しています。計算では、ピペッティングエラーは考慮されていません。crRNAライブラリの場合は、[ウェル数]x[nmol/ウェル]の計算式で、必要なtracrRNAの概算量を決定します。たとえば、ウェルあたり0.5 nmolの100ウェルライブラリーには、50 nmolのtracrRNAが必要です。大規模なライブラリプロジェクトには、バルクサイズのtracrRNAをお勧めします。
| crRNA nmol | tracrRNA nmol | 96-well plate 100 µL reaction volume | 24-well plate 500 µL reaction volume | 12-well plate 1000 µL reaction volume | 6-well plate 2500 µL reaction volume |
|---|---|---|---|---|---|
| 2 | 2 | 800 | 160 | 80 | 32 |
| 5 | 5 | 2000 | 400 | 200 | 80 |
| 10 | 10 | 4000 | 800 | 400 | 160 |
| 20 | 20 | 8000 | 1600 | 800 | 320 |
SAM細胞株における標的遺伝子の転写活性化
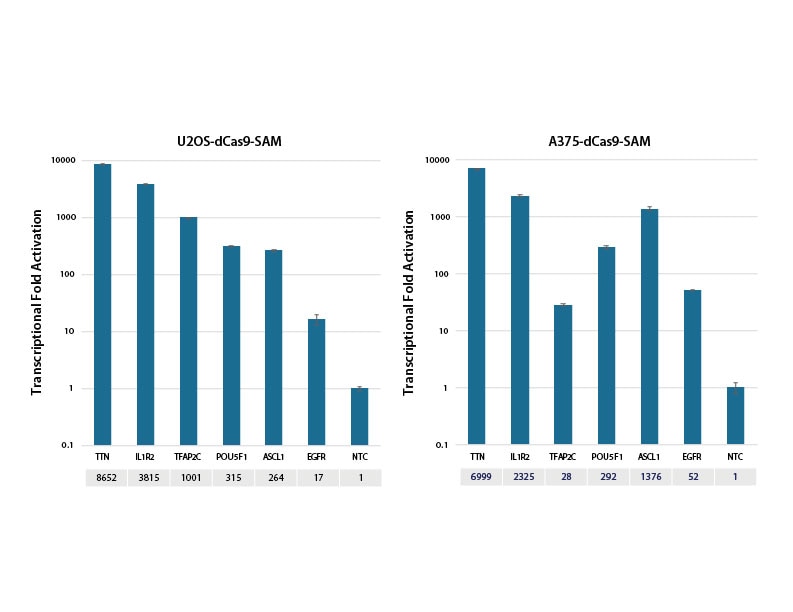
dCas9-VP64およびMS2-p65-HSF1(dCas9-SAM)を安定して発現するU2OSおよびA375細胞を10,000細胞/ウェルでプレーティングし、化学合成crRNA:tracrRNA(25nM )をDharmaFECT 4(U2OS)またはDharmaFECT 1(A375)トランスフェクション試薬でトランスフェクトしました。各遺伝子を標的とする4種類のデザイン済みcrRNAをプール(合計濃度:25nM)しました。トランスフェクションの72時間後に細胞を回収し、RT-qPCRを使用して相対的な遺伝子発現を計算しました。各遺伝子の相対的発現は、ハウスキーピング遺伝子としてPPIBを使用するΔΔCq法で計算し、non-targetingコントロールに対して正規化しました。
U2OS-dCas9-SAM細胞株における標的遺伝子の転写活性化:individualおよびプールフォーマットcrRNA
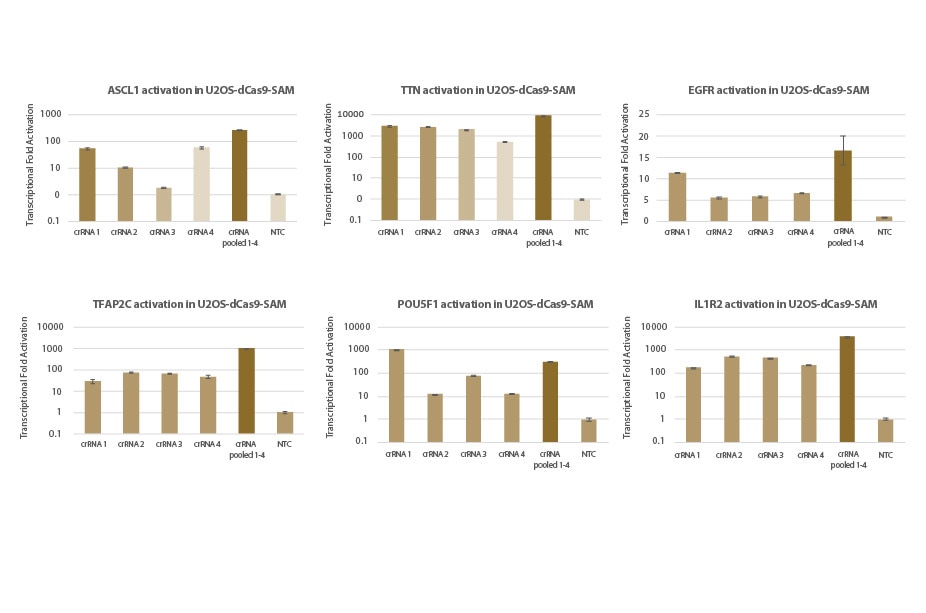
dCas9-VP64およびMS2-p65-HSF1(dCas9-SAM)を安定して発現するU2OS細胞を10,000細胞/ウェルでプレーティングし、化学合成crRNA:tracrRNA(25nM)を、DharmaFECT 4トランスフェクション試薬を使用してトランスフェクトしました。各遺伝子を標的とする4種類のデザイン済みcrRNAを個別、またはプールフォーマットでトランスフェクトしました(合計濃度:25nM)。トランスフェクションの72時間後に細胞を回収し、RT-qPCRを使用して相対的な遺伝子発現を計算しました。各遺伝子の相対的発現は、ハウスキーピング遺伝子としてPPIBを使用するΔΔCq法で計算し、non-targetingコントロールに対して正規化しました。
A375-dCas9-SAM細胞株における標的遺伝子の転写活性化:individualおよびプールフォーマットcrRNA
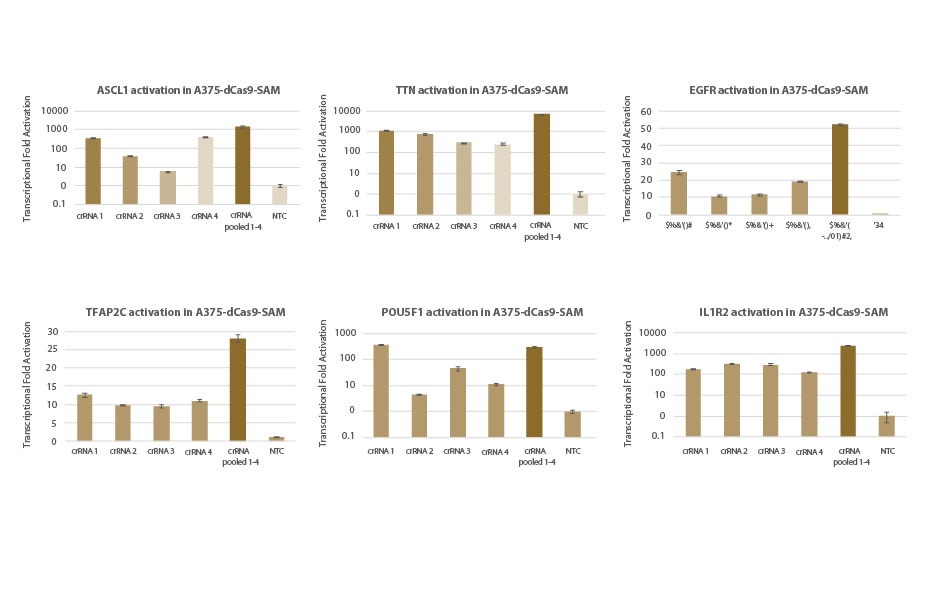
dCas9-VP64およびMS2-p65-HSF1(dCas9-SAM)を安定して発現するA375細胞を10,000細胞/ウェルでプレーティングし、化学合成crRNA:tracrRNA(25nM)を、DharmaFECT 1トランスフェクション試薬を使用してトランスフェクトしました。各遺伝子を標的とする4種類のデザイン済みcrRNAを個別、またはプールフォーマットでトランスフェクトしました(合計濃度:25nM)。トランスフェクションの72時間後に細胞を回収し、RT-qPCRを使用して相対的な遺伝子発現を計算しました。各遺伝子の相対的発現は、ハウスキーピング遺伝子としてPPIBを使用するΔΔCq法で計算し、non-targetingコントロールに対して正規化しました。
CRISPRa SAMワークフロー
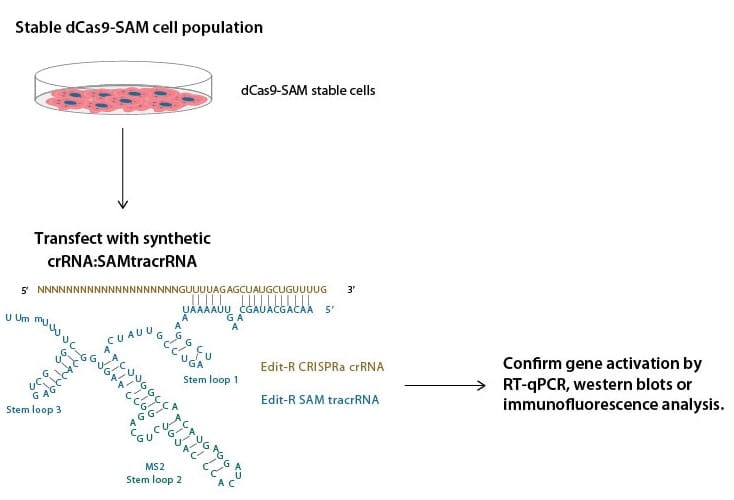
HorizonのCRISPRmod MS2 tracrRNA(以前の名称はSAM tracrRNA)には、MCP-p65-HSF1と結合するMS2アプタマー配列をstem loop 2上に含んでいます。触媒的に不活化されたCas9-VP64および遺伝子特異的なCRISPRa crRNAと組み合わせることで、SAM(synergistic activation mediator)システムを利用して、強力な転写活性化が実現します。
