SMARTvector Inducible Lentiviral shRNA
厳密に制御された遺伝子ノックダウン実験が可能な最も先進的で柔軟な単一ベクター誘導性shRNA

SMARTvector Inducible Lentiviral shRNA
1Start Here
2Choose
SMARTvector Inducible Lentiviral shRNAは、誘導性RNAiの新しいスタンダード製品です。
SMARTvector Inducible Lentiviral shRNAは、SMARTvector shRNAの最先端のデザインアルゴリズムとプロモーターや蛍光レポーターオプションの柔軟性に、Tet-On 3Gテトラサイクリン誘導発現システムを組み合わせています。この新しい単一ベクター制御性RNAiシステムにより、shRNAの発現が厳密に制御された安定した細胞を迅速に作製できます。
SMARTvector Lentiviral shRNAは、最先端のmicroRNAベースのshRNA専用の合理的な設計アルゴリズムを使用して設計されており、非常に強力で特異的な配列が得られます。実験に使用する細胞と実験条件に合わせて4つのプロモーター*(hCMV, mCMV, hEF1α, PGK)、2つの蛍光レポーター(TurboGFPおよびTurboRFP)搭載タイプから選択できます。ヒト・マウス・ラットのほぼ全ての遺伝子について、最大10個のshRNAノックダウンコンストラクトをデザイン済みです。
Tet-On 3Gプロモーターは漏出が最小限に抑えられるため、ドキシサイクリンの非存在下では標的遺伝子は野生型に近い発現をしますが、ドキシサイクリン存在下では強力な遺伝子ノックアウトが保証されます。ドキシサイクリンにより誘導されると、SMARTvector Inducible Lentiviral shRNAは非常に強力であり、非常に低い感染多重度(MOI)でも非常に効率的なノックダウンを実現します。
フォーマットの選択が不明な場合は、SMARTchoice Platformをご確認ください。
Highlights
SMARTvector Inducible Lentiviral shRNAベクターは、堅牢で制御可能で再現性のあるshRNAベースの遺伝子ノックダウンのために、以下のような強力な機能を備えています。
- ヒト、マウス、ラットの遺伝子をターゲットにし、目的の細胞に合わせて複数のプロモーターオプションを選択できます。
- 遺伝子ノックダウン保証(Guaranteeタブを参照してください)
- 内在性RNAi経路を介して非常に効率的にプロセッシングされるmicroRNA scaffoldを採用して設計されています。
- 最新世代のTet誘導発現技術であるTet-On® 3G誘導システムを利用して、shRNAとレポーター遺伝子発現を厳密に制御できます。
- 大腸菌グリセロールストックあるいは精製された濃縮レンチウイルス粒子(1 x 107 TU/mL ± 20%の高力価)をご用意しています。(力価はGFP陽性HEK293T細胞のFACS解析によって決定されています。)
- 初代細胞、神経細胞、幹細胞などのトランスフェクションが困難な細胞を含む、分裂および非分裂細胞タイプにも使用可能です。
これらの特性はレンチウイルスを介したRNAiの機能性と特異性を大幅に強化し、低力価の調製物(上清)に関連する毒性を低減します。
単一ベクター内の最適化された誘導性遺伝子ノックダウンシステム
SMARTvector Inducible Lentiviral shRNAベクターは、Tet-On® 3G二分誘導システムを組み込んでいます。第3世代のTet誘導性システムは、大幅に改善され、最小限の基礎発現(最低の漏出)と誘導時の強力な活性化のために最適化されています。Tet-On®3G Inducible Systemは、厳密に制御されたshRNA発現と、in vivoおよびin vitroでの遺伝子機能の研究をかつてない精度で可能にします。
SMARTvector Inducible Lentiviral shRNAベクター属性を選択する柔軟性
SMARTvector shRNAおよびレポーター遺伝子の誘導性制御はTet 3Gプロモーター(PTRE3G)によって付与されますが、Tet-On® 3Gトランスアクチベータータンパク質の発現は恒常的RNA pol IIプロモーターの制御下にあります。恒常的RNA pol IIプロモーターの選択は、PuroRおよびTet-On® 3Gトランスアクチベータータンパク質の確実な生産を確保するために重要です。これにより、形質導入細胞の抗生物質選択および厳密に制御されたshRNAの発現が可能になります。プロモーター活性は、さまざまな細胞株によって大きく異なり、その結果、shRNAを介した遺伝子ノックダウンの有効性と効力に影響を及ぼします。SMARTvector Inducible Lentiviral shRNAには、4つの構成的プロモーターと2つの蛍光レポーターオプションが含まれているため、RNAi実験の成功の機会が最大化されます。
SMARTvectorレンチウイルスshRNAの合理的デザインアルゴリズムにより、ゲノム当たり1コピーの導入で強力なノックダウンを実現
- 内在性RNAi経路を介して効率よくプロセッシングされる独自のmicroRNAベースshRNAを採用しています。
- 成熟鎖がRISCに優先的に取り込まれ活性が高い
- 合理的に設計された、高度に機能的な遺伝子ターゲティング配列です。
- 機能的ノックダウンテスト用に500以上の内在性mRNAデータポイントでトレーニングされたアルゴリズムでデザインされています。
- オフターゲット遺伝子ノックダウンを低減するためのバイオインフォマティクス戦略を組み込んでいます。
- microRNAシード領域配列頻度が低いshRNAデザインの選択
- 既知のmicroRNAおよび毒性ヌクレオチドモチーフのshRNAデザインの追加フィルタリング
- タンパク質をコードする遺伝子はORFと3’UTRで標的とされます。Long non-coding RNAは、転写産物の全長にわたって標的とされます。
これまでにないレベルの感度と遺伝子サイレンシングの制御を実現します。
遺伝子がノックダウンされるタイミングと程度を制御する機能は、生物学的に関連する生理学的および疾患関連の条件下で、in vitroおよびin vivoでの遺伝子機能を解明するタスクに非常に貴重であることが証明されています。制御可能なRNAiシステムは、ノックダウンすると細胞の状態とダイナミクスに有害な影響または不可逆的な変化を引き起こす可能性がある遺伝子の機能分析に特に役立ちます。SMARTvector Inducible Lentiviral shRNAプラットフォームは、以下を含む多くのアプリケーションに利用することができると考えられます。
in vitroアプリケーション
- 遺伝子機能の研究
- 経路とネットワークのモデリング
- 成体/胚細胞の運命を操作する
- 疾患細胞モデル作製
- 薬物標的と作用機序(MOA)の検証
ex vivoアプリケーション
- 腫瘍表現型検証
- 成体/胚細胞の運命を操作する
in vivoアプリケーション
- 進行性疾患のモデリング
- トランスジェニックモデルの開発
レンチウイルス粒子フォーマット
Dharmaconでは、高品質のレンチウイルス粒子製製品の提供に取り組んでいます。そのため、厳密なQCコントロール下で、各コンストラクトをクローニング、パッケージ化、および濃縮しています。レンチウイルス粒子の生産と品質管理手順の固有の複雑さのため、製造期間は4〜6週間と推定されています。次の形式を提供しています。
Set of 3:3つの異なる遺伝子ターゲティングコンストラクトのセット
- 同じ遺伝子を標的とする複数のshRNAを評価し、使用する細胞でのmRNAノックダウンをより確実にするために最適です。
- 100 µL (4 x 25 µL), 1 x 107 TU/mL ± 20%、または200 µL (8 x 25 µL), 1 x 107 TU/mL ± 20%(力価はGFP陽性HEK293T細胞のFACS解析によって決定されています。)
Individual:個々の遺伝子ターゲティングコンストラクト
- 最高のパフォーマンスを発揮するものとして決定した1~2つのコンストラクトの注文に最適
- 100 µL (4 x 25 µL), 1 x 107 TU/mL ± 20%、または200 µL (8 x 25 µL), 1 x 107 TU/mL ± 20%(力価はGFP陽性HEK293T細胞のFACS解析によって決定されています。)
MARTvector Inducible Lentiviral ポジティブおよびネガティブコントロール
- 遺伝子特異的な実験の前に、形質導入およびアッセイ条件を最適化します。
- ネガティブコントロール粒子:シーケンス固有/非固有のノックダウン効果を区別できます。
- ポジティブコントロール粒子:ハウスキーピング遺伝子を標的とする確認済みのshRNAコンストラクトを使用して、遺伝子ノックダウンを確認できます。
- 50 µL (2 x 25 µL), 1 x 107 TU/mL ± 20%(力価はGFP陽性HEK293T細胞のFACS解析によって決定されています。)
SMARTvector Inducible Lentiviral shRNA機能保証
同一遺伝子(タンパク質をコードする遺伝子に限る)をターゲットとする3種類以上のshRNAクローンを用いて実験を行った場合、そのうち1つについて、mRNAレベルで70%以上の遺伝子発現抑制を保証します。この機能保証では、使用する細胞に最適なプロモーターを搭載したターゲットshRNAクローンとともにnon-targeting コントロールおよびGAPD/PPIBポジティブコントロール(いずれもターゲットshRNAクローンと同一のプロモーターおよび蛍光マーカーを搭載しているもの)を用いて同一条件下で同時に実験を行い、ポジティブコントロールが十分に機能しているコントロール実験のデータが必須となります。使用する細胞に最適なプロモーターはSMARTchoice Inducible Non-targeting Control 4-packを用いて決定してください。また、最適なドキシサイクリン濃度は SMARTvector Inducible Lentiviral shRNA Technical Manual に従って検討してください。ノックダウン効率は、ドキシサイクリンによる誘導から72時間以内に、non-targeting コントロールを導入した細胞に対して定量RT-PCR法を用いて評価してください。なお、この機能保証は、製品コードがV3S*xxxxである製品のみに適用され、また、long noncoding RNAをターゲットとする製品には適用されません。
shRNA コントロール
SMARTvector Inducible Lentiviral shRNAコントロール
- 4つのプロモーターと2つの蛍光レポーターを選択できるポジティブおよびネガティブshRNAコントロール
SMARTvector Lentiviral shRNAベクターデザイン
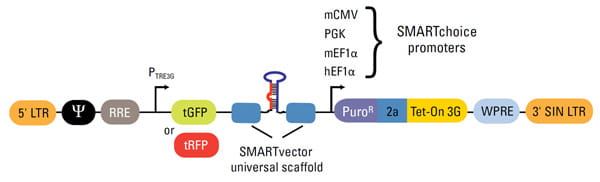
| Vector Element | Utility |
|---|---|
| 5' LTR | 5' Long Terminal Repeat necessary for lentiviral particle production and integration of the construct into the host cell genome |
| Ψ | Psi packaging sequence allows viral genome packaging using lentiviral packaging systems |
| PTRE3G | Inducible promoter with Tetracycline Response Element is activated by the Tet-On® 3G protein in the presence of doxycycline |
| tGFP or tRFP | TurboGFP or TurboRFP reporter for visual tracking expression upon doxycycline induction |
| SMARTvector universal scaffold | Optimized proprietary scaffold based on native primary microRNA in which gene-targeting sequence is embedded |
| PuroR | Puromycin resistance permits antibiotic selection of transduced cells |
| 2a | Self-cleaving peptide enables the expression of both PuroR and Tet-On® 3G transactivator from a single RNA pol II promoter |
| Tet-On® 3G | Encodes the doxycycline-regulated transactivator protein, which binds to PTRE3Gpromoter only in the presence of doxycycline |
| WPRE | Woodchuck Hepatitis Post-transcriptional Regulatory Element enhances transgene expression in target cells |
| 3' SIN LTR | 3' Self-inactivating Long Terminal Repeat for generation of replication-incompetent lentiviral particles |
単一ベクターにおける最適化された誘導的遺伝子ノックダウンシステム
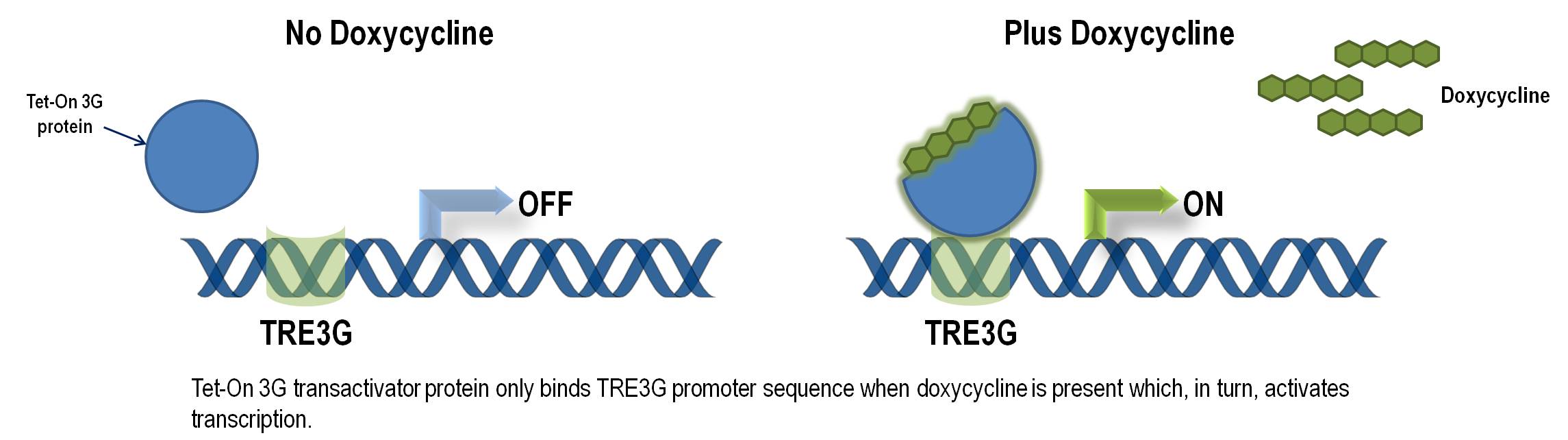
SMARTvector Inducible Lentiviral shRNAベクターは、Tet-On® 3G二部誘導システムを組み込んでいます。第3世代のTet誘導システムは、最小限の基礎発現(最小の漏れ)と誘導時の強力な活性化のために大幅に改善および最適化されています((Zhou X, et al., Gene Therapy 13, 1382 (2006)およびLoew R, et al., BMC Biotechnol. 10, 81 (2010))。Tet-On® 3G誘導システムにより、厳密に制御されたshRNA発現と、in vivoおよびin vitroでの遺伝子機能の研究が、前例のない精度で可能になります。
癌細胞株におけるSMARTvector Inducible Lentiviral shRNA発現の誘導は強力であり、ドキシサイクリンの用量依存的に厳密に制御可能
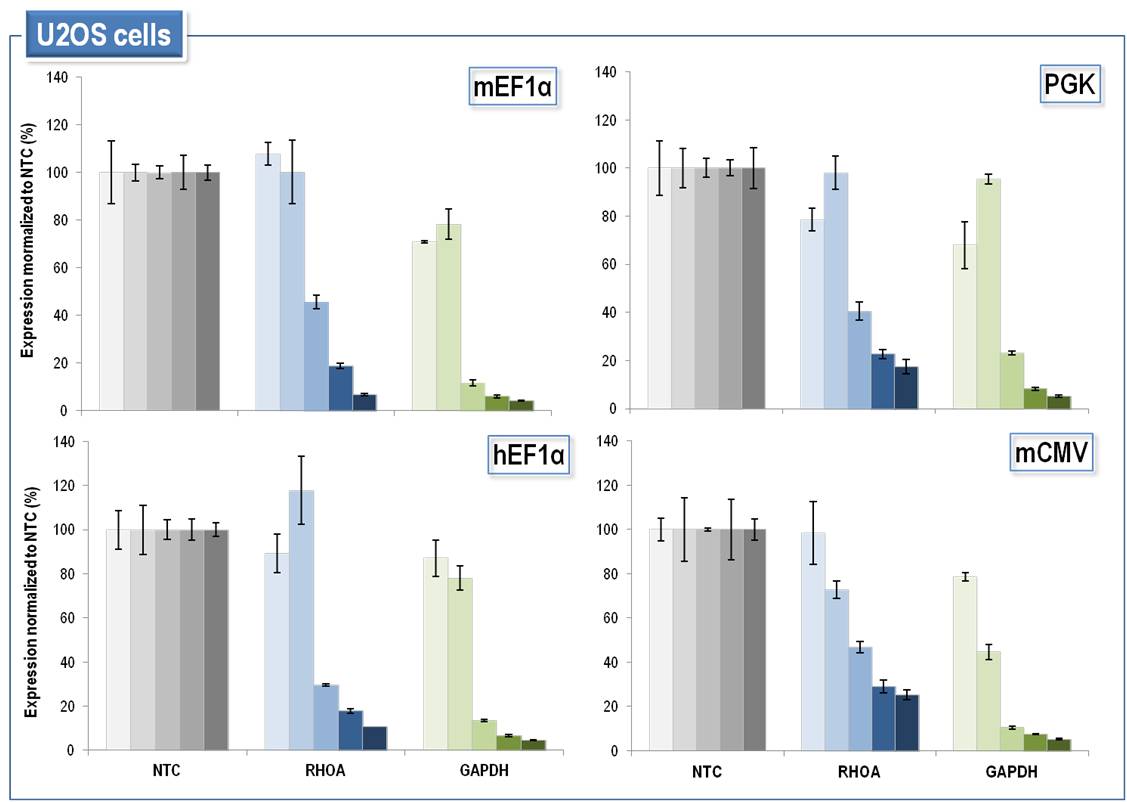
癌細胞株におけるSMARTvector Inducible Lentiviral shRNA発現の誘導は、ドキシサイクリンの用量依存的であり、堅牢で厳密に制御可能です。U2OS(ヒト骨骨肉腫上皮)細胞に、non-targetingコントロールshRNA(NTC)またはRHOA、GAPDHに対するshRNAを含むSMARTvector Inducible Lentiviral shRNAベクターをMOI = 0.2で形質導入しました。1.5 µg/mLピューロマイシンで72時間細胞を選択し、次に、shRNAの発現をそれぞれ0、0.01、0.1、1.0、10 µg/mLのドキシサイクリンで誘導し、dox誘導の72時間後にmRNAを回収しました。標的遺伝子ノックダウンは、PPIB参照遺伝子と比較してRT-qPCRによって測定しました。遺伝子ノックダウンは、ベクターおよびドキシサイクリンの投与量が一致したNTC細胞集団と比較して表示しています。
SMARTvector Inducible Lentiviral shRNA発現の誘導は一時的に制御され、非常に低いMOIで非常に効率的な遺伝子ノックダウンをもたらす
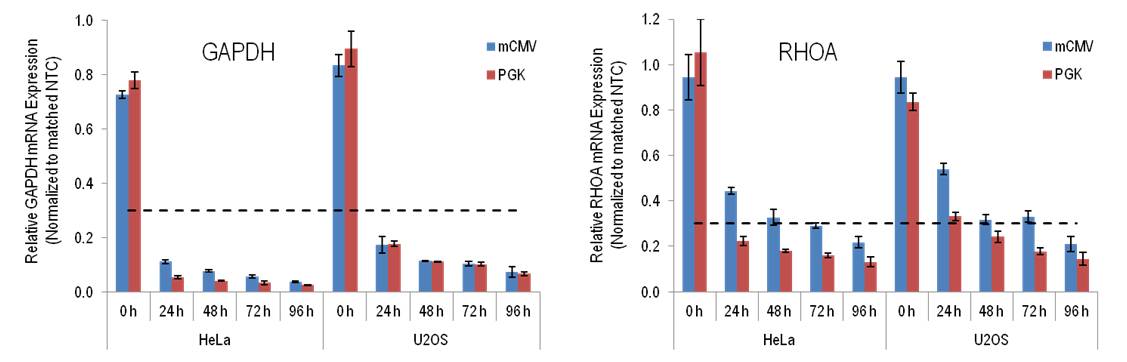
SMARTvector Inducible Lentiviral shRNA発現の誘導は一時的に制御され、非常に低いMOIで非常に効率的な遺伝子ノックダウンをもたらします。図に示すようにU2OSおよびHeLa細胞に、non- targetingコントロール(NTC)shRNAまたはGAPDH、RHOAのいずれかに対するshRNAを含むSMARTvector Inducible Lentiviral shRNAベクターをMOI = 0.15で形質導入しました。細胞を2 µg/mLピューロマイシンで3日間選択し、さらに最大4日間増殖培養した後、安定した集団を凍結して保存しました。その後、細胞を解凍し、増殖させ、プレーティングしました。shRNAの発現は、同時採取の0、24、48、72、96時間前に誘導しました。標的遺伝子ノックダウンは、PPIB参照遺伝子と比較してRT-qPCRによって測定しました。遺伝子ノックダウンは、ベクターと時間の一致したNTC細胞集団と比較して表示しました。
SMARTvector Inducible Lentiviral shRNAは、4つのプロモーターオプションすべての使用において、マウス細胞内の特定の標的遺伝子の調整可能なノックダウンを可能にする
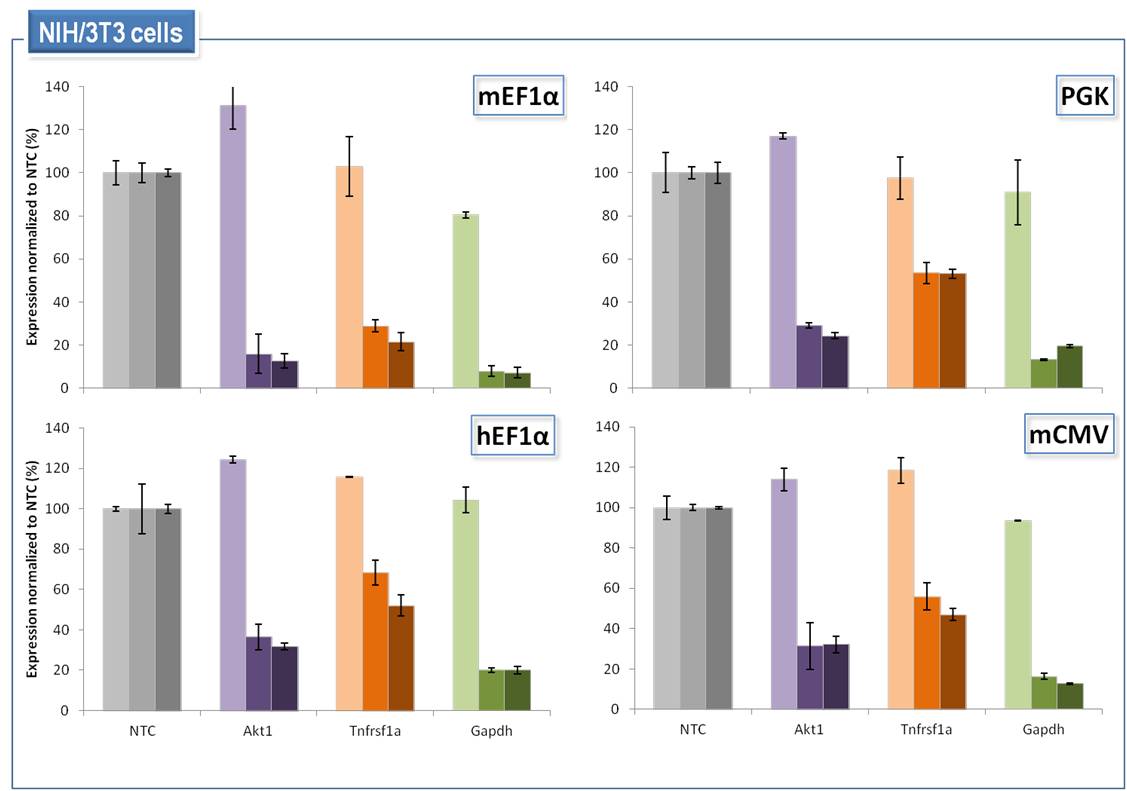
SMARTvector Inducible Lentiviral shRNAは、4つのプロモーターオプションすべてを使用して、マウス細胞内の特定の標的遺伝子の調整可能なノックダウンを可能にします。マウスNIH/3T3細胞に、non-targetingコントロールshRNA(NTC)またはAkt1、Tnfrsf1αまたはGapdhに対するshRNAを含むSMARTvector Inducible Lentiviral shRNAベクターをMOI = 0.1で6 µg/mLポリブレンを使用して形質導入しました。細胞は3 µg/mLピューロマイシンで72時間選択しました。次に、shRNAの発現をそれぞれ0、0.5、1.0 µg/mLのドキシサイクリンで誘導し、dox誘導の72時間後にmRNAを回収しました。標的遺伝子ノックダウンは、Ppib参照遺伝子と比較してRT-qPCRによって測定しました。遺伝子ノックダウンは、ベクターおよびドキシサイクリンの投与量が一致したNTC細胞集団と比較して表示しています。
SMARTvector Inducible Lentiviral shRNAは、4つのプロモーターオプションすべての使用において、ヒト初代細胞の特定の標的遺伝子の調整可能なノックダウンを可能にする
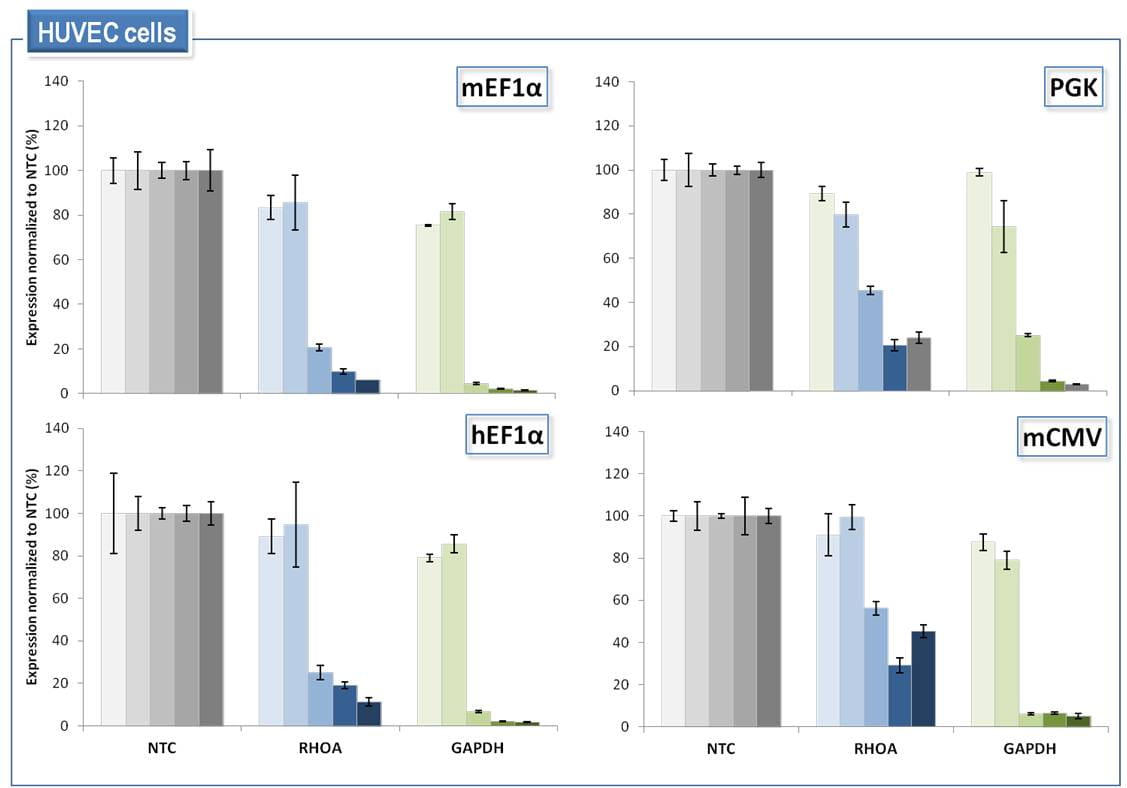
HUVEC(初代ヒト臍帯静脈内皮)細胞に、non-targetingコントロールshRNA(NTC)またはRHOA、GAPDHに対するshRNAを含むSMARTvector Inducible Lentiviral shRNAベクターをMOI = 0.2で形質導入しました。1.5 µg/mLピューロマイシンで72時間細胞を選択しました。次に、shRNAの発現をそれぞれ0、0.01、0.1、1.0、10 µg/mLのドキシサイクリンで誘導し、dox誘導の72時間後にmRNAを回収しました。標的遺伝子ノックダウンは、PPIB参照遺伝子と比較してRT-qPCRによって測定しました。遺伝子ノックダウンは、ベクターおよびドキシサイクリンの投与量が一致したNTC細胞集団と比較して表示しています。
SMARTvector Inducible Lentiviral shRNAは、時間およびドキシサイクリンの用量依存的に必須遺伝子の厳密に制御されたノックダウンを可能にする
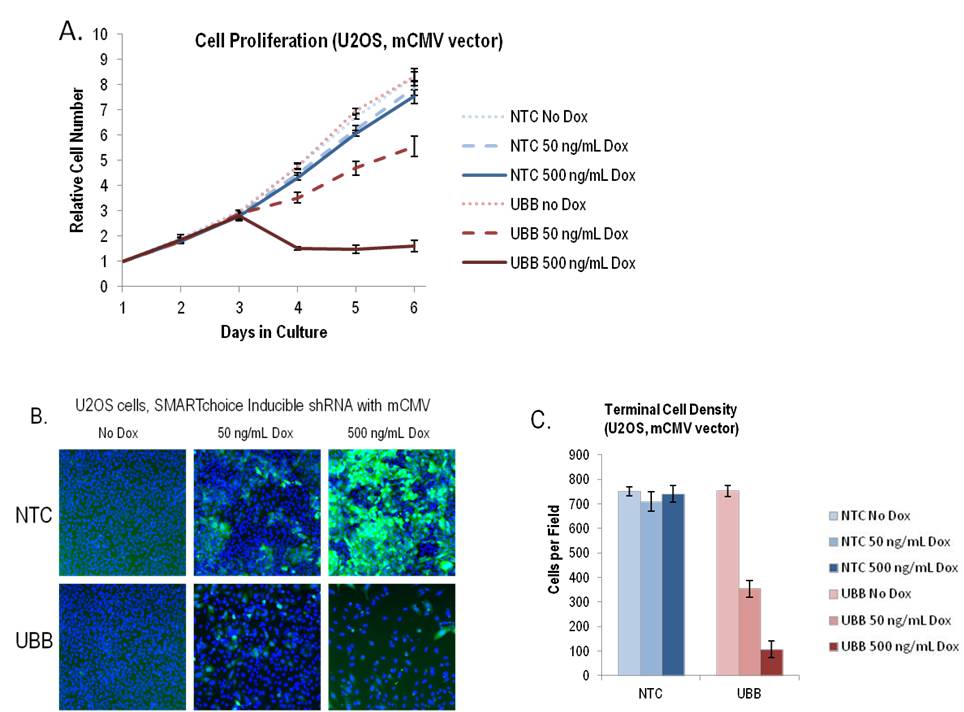
A: U2OS細胞に、non-targetingコントロールshRNA(NTC)またはユビキチンB(UBB)遺伝子に対するshRNAのいずれかを運ぶSMARTvector Inducible Lentiviral shRNAベクター(mCMVプロモーター)をMOI = 0.1で形質導入しました。1.5 µg/mLピューロマイシンで3日間細胞を選択し、選択後、細胞を96ウェルプレートに1ウェルあたり2000細胞で播種しました。24時間後(1日目)、指示された用量のドキシサイクリンでshRNA発現を誘導し、CellTiter-Glo®アッセイ(Promega)で細胞数を毎日測定しました。各データポイントは、6つの独立したウェルの平均と標準偏差を表します。
B: 6日目に、ドキシサイクリンへの5日間の曝露後、細胞をHoescht 33342で染色し、細胞核(青)とTurboGFP(緑)をArrayScan™ VT IHCSリーダーで画像化しました。
C:フィールドあたりの核の数として定義される細胞密度は、条件ごとに18フィールドについて計算しました。
SMARTvector Inducible Lentiviral shRNAプロモーター活性は細胞タイプによって異なる
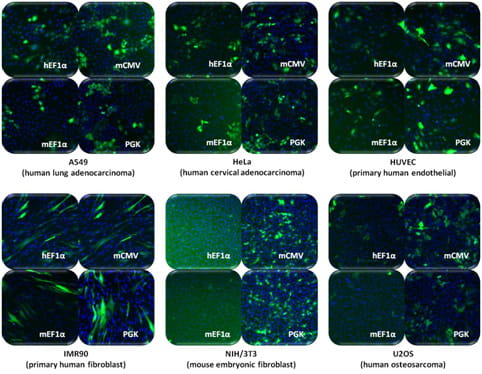
図中の細胞株に、SMARTvector Inducible Lentiviral shRNA Non-targetingコントロールをMOI = 0.3で形質導入しました。形質導入の24時間後、non-targeting shRNAおよびTurboGFPの発現を1 µg/mLドキシサイクリンで誘導しました。ドキシサイクリンの存在下で48時間培養した後、細胞をHoescht-33342で染色し、核(青)とTurboGFP(緑)を画像化しました。フィールド内の細胞の約30%が形質導入されていますが、特定の細胞タイプでは、恒常的プロモーター活性が低いことを示すTurboGFP発現が低いため、一部の画像には30%未満のTurboGFP陽性細胞が含まれているように見える場合があります。
内在性microRNAの機能は異なる
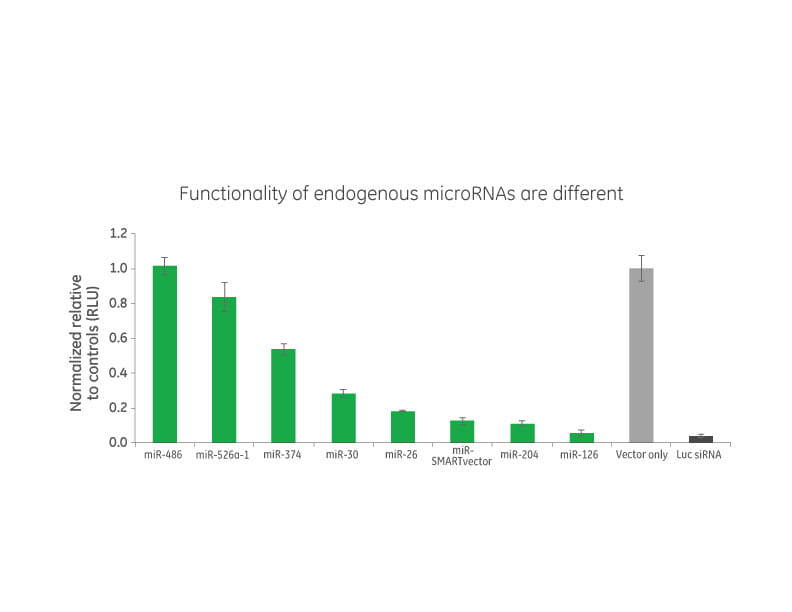
レンチウイルスサイレンシングコンストラクトへの高度に機能的で適切に処理されたmicroRNA scaffoldの組み込みは、DNAベースのRNAiサイレンシングの機能を大幅に強化します。さまざまな内在性ヒトmicroRNAを、それぞれのターゲットをサイレンシングする能力についてHeLa細胞でテストしました。各microRNAは独特のレベルの機能を示します。いくつかのコンストラクト(例えば、miR-486および-526a)は低レベルの活性を示し、それぞれのレポーターコンストラクトを20%未満サイレンシングしましたが、ネイティブmiR-30および-374 scaffoldは中程度のレベルの遺伝子サイレンシングを提供します(〜50-70%、上図を参照)。 SMARTvector Inducible Lentiviral shRNAの基礎として選択されたscaffoldは、それぞれのターゲットを効率的にプロセッシングし、80〜90%サイレンシングしました。この非常に機能的なmicroRNAは、RNAi発現プラットフォームで使用されている現在利用可能なmicroRNAベースのscaffoldを大幅に改善したものです。
内在性microRNAの成熟鎖とパッセンジャー鎖の機能は異なる
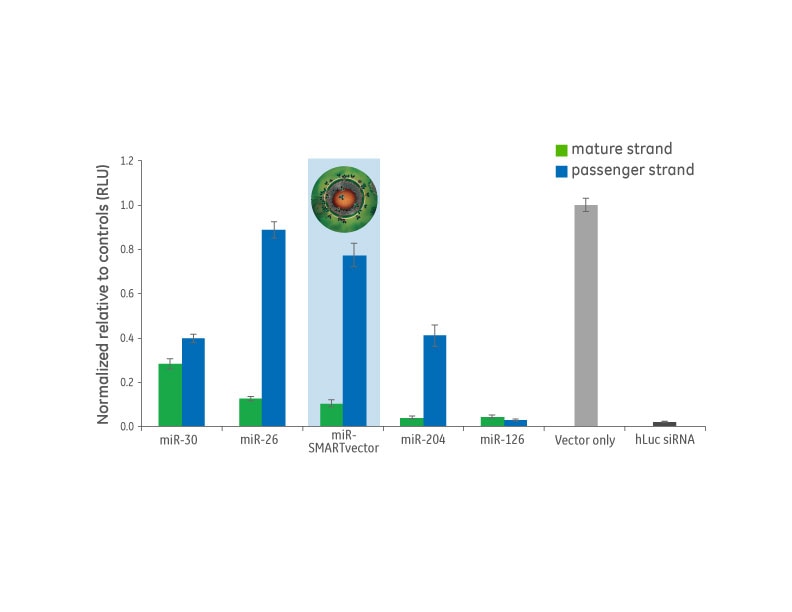
好ましいmicroRNA scaffoldは、最小限のパッセンジャー鎖に起因するオフターゲット効果が最小限に抑えられます。Dharmaconチームは、プライマリスクリーンでテストされたいくつかのscaffoldのパッセンジャー鎖活性を調査しました。中程度に機能するmiR-30と高度に機能するmiR-126は、望ましくないパッセンジャー鎖活性を示します。対照的に、miR-SMARTvectorは、最小限のパッセンジャー鎖活性で強力な成熟鎖活性を示します。
microRNAベースshRNAとシンプルヘアピン型shRNAの比較
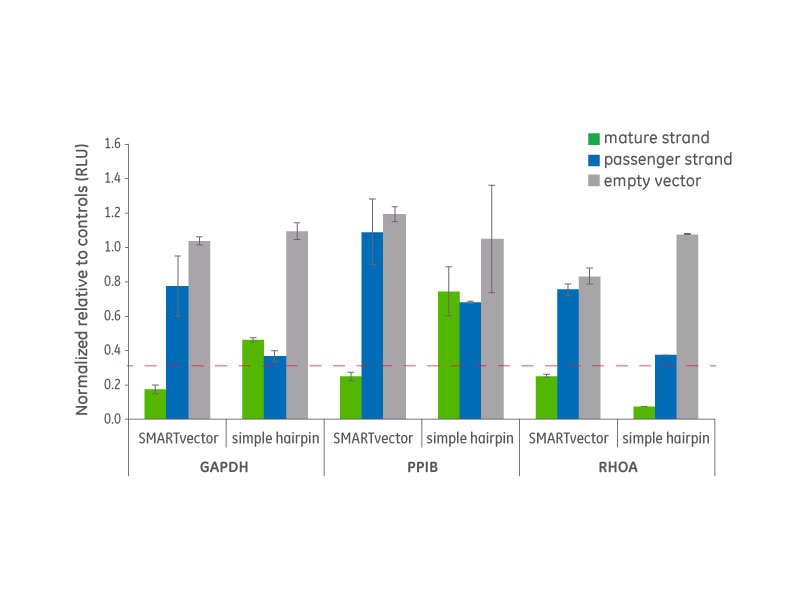
SMARTvector microRNAに適用したshRNAプラットフォームは、同じ遺伝子をターゲットとするシンプルヘアピン型shRNAよりも、かなり高い成熟鎖活性と低いパッセンジャー鎖活性を示します。最適化されたmicroRNAに適合したscaffoldの結果は、パッセンジャー鎖に起因するオフターゲット効果のリスクを低減しながら、より高く、より特異的な機能になります。
Tet -inducible expression system references:
- Loew R, Heinz N, et al., Improved Tet -responsive promoters with minimized background expression. BMC Biotechnol . 10, 81 (2010).
- Zhou X, Vink M, et al., Optimization of the Tet -On system for regulated gene expression through viral evolution. Gene Ther . 13(19), 1382-1390 (2006).
LentiBOOST Lentivirus Transduction Enhancer is a uniquely formulated transduction reagent that can be used with or without lentivirus spinfection in order to increase successful viral transduction events while preserving cell viability. Especially critical for preserving precious primary cells from patient cohorts, or, for engineering complex animal models; improving transduction efficiency can save time and costs by increasing the success of each editing/transduction step, or, even avoid the loss of irreplaceable samples. Additionally, LentiBOOST technology is already used in the manufacturing of a number of clinical stage therapies providing the opportunity to demonstrate improved workflow applicability to the clinic.
LentiBOOST can be purchased through the Dharmacon Reagents catalog.
To learn more about LentiBOOST technology visit the Revvity LentiBOOST webpage.
Supporting Data
Improved CD8+ T-cell SMARTvector™ shRNA lentiviral system transduction using LentiBOOST™ Lentivirus Transduction Enhancer
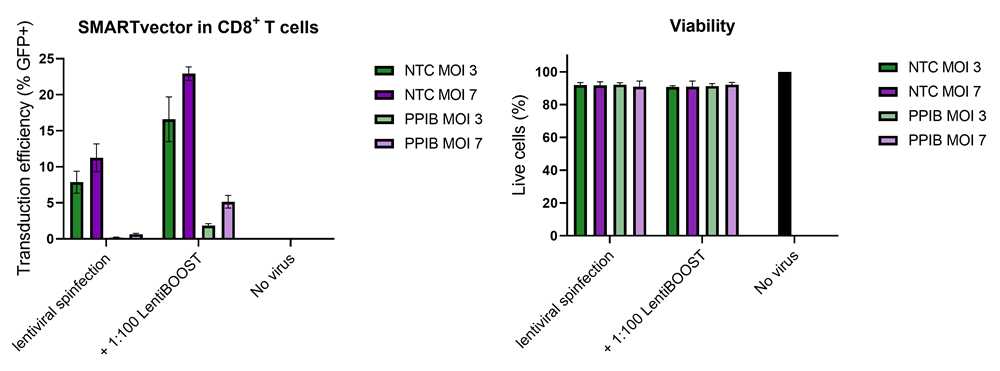
100,000 primary human CD8+ T cells were transduced with either 30,000 (MOI 3, green) or 70,000 (MOI 7, purple) TUs of SMARTVector™ mCMV tGFP Lentiviral Control Particles targeting either NTC or PPIB along with 1:100 LentiBOOST transduction enhancer. Cells were centrifuged at 800 x g for one hour at 32 °C followed by a four hour incubation prior to removal of lentiviral particles and transduction enhancer. Transduction efficiency (%GFP+ out of live cells) and viability were determined 5 days post-transduction by flow cytometry. The addition of LentiBOOST technology markedly improved transduction efficiencies without significantly impacting cell viability.
Improved CD4+ and CD8+ T-cell Edit-R™ All-in-one sgRNA/Cas9 lentiviral system transduction using LentiBOOST™ Lentivirus Transduction Enhancer
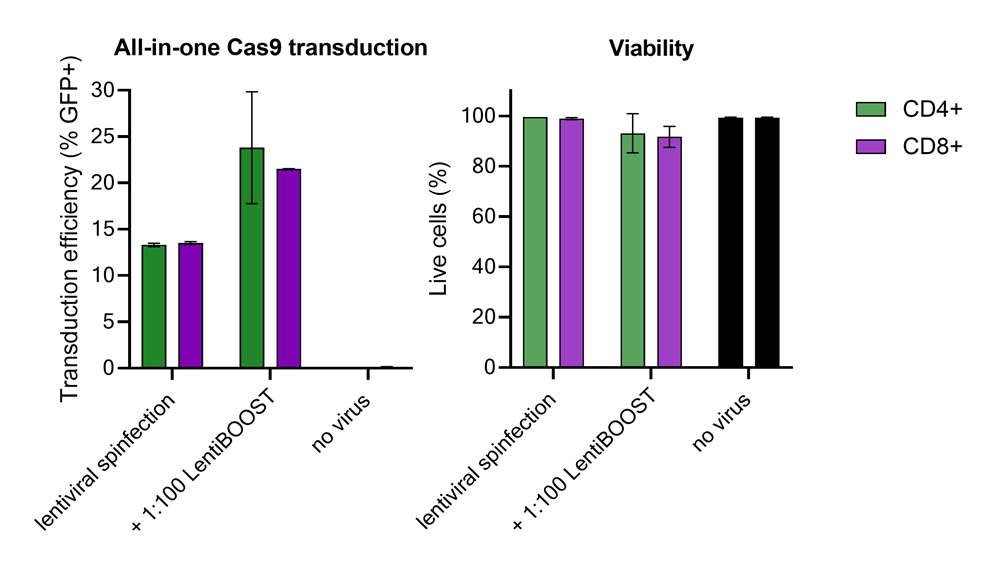
100,000 primary human CD4+ and CD8+ T cells from two donors were transduced with 250,000 TUs of Edit-R GFP Delivery controls mCMV along with 1:100 LentiBOOST transduction enhancer. Cells were centrifuged at 800 x g for one hour at 32 °C followed by an overnight incubation prior to removal of lentiviral particles and transduction enhancer. Transduction efficiency and viability were determined 72 hours post-transduction by flow cytometry. The addition of LentiBOOST technology markedly improved transduction efficiencies without significantly impacting cell viability.
Improved transduction of human induced pluripotent stem cells (hiPSCs) with the Strict-R™ Inducible CRISPRa lentiviral system transduction using LentiBOOST™ Lentivirus Transduction Enhancer

10,000 WTC hiPS cells were transduced with either 20,000 (MOI 2, green) or 40,000 (MOI 4, purple) TUs of Strict-R™ Inducible EGFP dCas9-VPR Lentiviral Particles along with 1:100 LentiBOOST transduction enhancer. Cells were centrifuged at 800 x g for one hour at 32 °C followed by an overnight incubation prior to removal of lentiviral particles and transduction enhancer. Transduction efficiency and viability were determined 72 hours post-transduction by flow cytometry. The addition of LentiBOOST markedly improved transduction efficiencies without significantly impacting cell viability.
Application notes
Protocols
Safety data sheets
Selection guides
Technical manuals
Related Products
SMARTvector Inducible shRNAを用いた実験の正確なデータ解釈のためのポジティブおよびネガティブコントロール
LentiBOOST transduction enhancer can increase successful viral transduction in challenging to transduce cells, or, complex cellular engineering work; while preserving cell viability and minimizing the amount of viral particles required for your experiment. LentiBOOST technology is actively used in the production of clinical stage lentivirally delivered therapies, including some approved therapies, providing a direct path to therapeutic applicability for your research studies. Tested with Dharmacon Lentiviral reagents.
shMIMIC Inducible Lentiviral microRNAs combine all the advantages of the unique shMIMIC microRNA expression design with the Tet-On 3G tetracycline-inducible expression system and the flexibility of SMARTchoice promoter and reporter options.
最先端のshRNAデザインによる遺伝子ノックダウンが保証され、複数のプロモーターおよびレポーターオプションが選択可能です。
