リキッドバイオプシーは、がん患者の腫瘍組織による検査に比べて多くの利点があります。外科的生検をすることなく低侵襲で患者の負担を減らすことができ、検出感度の向上により低頻度の体細胞原因遺伝子変異を検出できるようになってきています。
リキッドバイオプシーは、がん遺伝子検査のための臨床サンプルを採取する方法として定着することが期待されています。診断時点のみならず、治療中の定期的なモニタリングの際に治療法の変更の必要性を示す耐性変異の発現を確認できる可能性があります。また、リキッドバイオプシーは、将来的には、一般集団の予防的がんスクリーニングに利用できる可能性もあります。病気の症状が現れる前に検査することにより、早期診断とよりよい治療結果が期待できます。
リキッドバイオプシーによる診断におけるcfDNA使用の課題とは?
新しいシーケンス技術と同様に、一般的な技術的ハードルには次のような事柄があります。
- サンプル処理:リキッドバイオプシーのワークフローには、追加のサンプル処理手順が含まれます。FFPEブロックの処理に精通している臨床検査室であっても、保存寿命の短い血液サンプルの処理においては、全血からの血漿分離、血漿からのcfDNA抽出などの複数のステップが必要となります。これらの抽出ステップはすべて、最終結果にエラーが発生しないように適切に検証する必要があります。
- 結果の信頼性:リキッドバイオプシーアッセイでは、FFPEサンプルのシーケンスアッセイよりもはるかに高い検出限界で解析する必要があります。そのため、解析法を厳密に検証し、偽陽性コールが無く、変異の5〜0.1%のアレル比まで正確にコールできることを確認する必要があります。
- サンプルのばらつき:臨床サンプルは、サンプル間で性状が多様で、同一プロトコールでの処理が困難な場合があります。さらに、施設間の採血や検体保存のプロセスの違いによってもサンプルのばらつきは大きくなります。このばらつきに左右されることのない一貫したプロトコールを導入することは、大規模なリキッドバイオプシーの実現を成功させるために不可欠です。
リキッドバイオプシーの2つの大きな課題
- 検出限界(LOD)と偽陽性率
- このcfDNAアッセイの信頼できる検出限界は1%AFです。
- このデータではNRAS A59Tの偽陽性コールが見られます。
- ヒト血漿のばらつきと不安定性
- 400 ngのcfDNAを1 mlのヒトまたは合成血漿にスパイクし、-80℃で保存しました。
- cfDNAはCirculating Nucleic Acidキット(Qiagen)を使用して抽出し、抽出効率はQubit BR試薬(分子プローブ)を使用して測定しました。
- AKT1遺伝子の総コピー数はddPCR(Bio-Rad)で定量化しました。
cfDNAを使用したがんの早期検出の重要な課題の1つは、患者の血液中のcfDNAの量が非常に少ないことです。これは、シーケンシングの際に、検査室がこれまでよりもはるかに低いアレル比を検出しなければならないことを意味します。
では、「検出限界での結果が偽陽性ではない」と確信するためにはどうすればよいでしょうか。
アレル比が正確に定義された標準サンプルを使用することにより、正確な検出限界を検証し偽陽性のリスクを減らすことができます。
| Gene | Variant | Allelic Frequency | |||
|---|---|---|---|---|---|
| 5% | 1% | 0.1% | 0% (WT) | ||
| EGFR | L858R | 5.0 | 1.0 | ND | ND |
| EGFR | ΔE746-A750 | 4.9 | 0.9 | ND | ND |
| EGFR | T790M | 4.9 | 1.1 | ND | ND |
| EGFR | V769-D770ins | 5.0 | 1.0 | ND | ND |
| KRAS | G12D | 5.1 | 1.0 | ND | ND |
| NRAS | Q61K | 4.9 | 0.9 | ND | ND |
| NRAS | A59T | 5.2 | 1.1 | 0.7 | 0.7 |
| PIKC3A | E545K | 5.0 | 1.0 | ND | ND |
この標準サンプルのデータセット例では、次のことが示唆されています。
臨床サンプルの前に標準サンプルを測定することにより、アッセイ検出限界を確認でき、また、一連の処理プロセスの最適化も可能です。ワークフローを再調整または修正して、間違った結果に対処することができます。これにより、実際の臨床サンプルにおいて、信頼性のある結果が得られます。
cfDNAアッセイのコントロールとしてヒト血漿を使用することに伴ういくつかの重要な課題があります。確かにヒト血漿は患者のサンプルに近いですが信頼できるアッセイコントロールとして使用する難しさを伴います。
| ヒト血漿 | Horizonの合成血漿 |
|---|---|
| 量と濃度が変動する | 量と濃度は定義済み |
| ロット間のばらつきあり | ロット間のばらつきが少ない |
| 不安定な供給 | 安定した供給 |
| 他の成分やゲノムDNAのコンタミネーション | 干渉する成分やゲノムDNAのコンタミネーション無し |
| 時間経過に伴うcfDNA分解による安定性の制限 | cfDNAの長期安定性(24か月以上) |
cfDNA合成マトリックス標準サンプルの性能データ
この実験では、ヒトまたは合成血漿のいずれかに、cfDNAをスパイクし、60週間にわたり安定性を確認しました。結果は、抽出できたcfDNAの量(平均抽出効率:約40%)とddPCRによって決定されたALK1の遺伝子コピー数が、-80℃で60週間保存した後のヒト血漿と合成血漿の両方で類似していたことを示しています。これは、Horizonの合成血漿が実際のヒト血漿と近い性状であり、適切なcfDNA標準サンプルマトリックスとして機能することを示しています。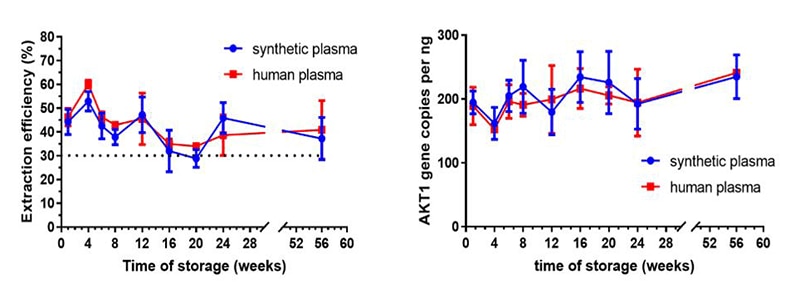
ワークフローを管理する
ddPCRのようなゴールドスタンダードの方法により確認された疾患関連変異を持つ、実際の臨床サンプルに類似した細胞株由来の標準サンプルを利用することで、新しいリキッドバイオプシーアッセイを適切に検証できます。。
次のことが可能になります。
- ワークフローが、偽陽性コール無しに、正しいアレル比でコントロールサンプル内のすべての変異を正確に検出することを確認します。
- DNA抽出手順におけるエラーの発生を検証および管理します。
- リキッドバイオプシーのシーケンスアッセイの設計がアンプリコンのドロップアウトなしに効果的に機能していることを確認します(リキッドバイオプシーアッセイは、新鮮凍結組織またはFFPEを用いたアッセイよりも小さなDNA断片からシーケンスする必要があります)。
Horizonは、新しい診断用検査の開発、最適化、モニタリング、および精度管理に役立つ一連の細胞株由来のcfDNA標準サンプルを開発しました。これらの標準サンプルは平均160 bpのサイズに断片化されたgDNAで、主要ながん遺伝子のアレル比がddPCRで確認されています。
合成血漿を用いたHorizonのcfDNA標準サンプルは、DNA抽出から結果の解釈まで、リキッドバイオプシーのワークフロー全体をモニタリングするのに役立ち、検査精度の信頼度を向上させます。
リキッドバイオプシーの未来は?
リキッドバイオプシーによるがん患者の検査、モニタリング、治療の未来は活発化しています。それは、簡単な採血で遺伝子にアプローチできるからです。疾患前の予防的モニタリング、診断、治療、腫瘍の進化、耐性管理、長期寛解の経過観察とフォローアップ等のがんゲノム医療のあらゆる側面でリキッドバイオプシーが利用されるようになるでしょう。
