CRISPRaを用いた遺伝子過剰発現実験は、DNAに永続的な変化を与えることなく、標的遺伝子の頑健かつ特異的な過剰発現を達成する強力な手段です。
CRISPRa実験では、三種の転写活性化因子(VP64、p65、Rta、あるいは "VPR")と融合した、改変されたヌクレアーゼ不活性化Cas9(dCas9)と、遺伝子プロモーター領域近傍を標的とするあらかじめデザインされたガイドRNAを細胞内に導入(あるいは滞留)させる必要があります。dCas-VPRとガイドRNAを細胞に導入するいくつかのオプションと組み合わせが存在し、それぞれが特定の細胞タイプ、科学的疑問、望ましい効果持続時間に対して意味を持ちます。CRISPRaのコンポーネントを細胞内に導入するための選択肢と考慮すべき点を列挙すると、以下のようになります:
dCas9-VPRとガイドの両方を安定的に発現する細胞株を入手、あるいは作製
- 活性化の延長により、長期の過剰発現表現型を可能にします。
- コンポーネントの安定発現は、活性化のタイミングを制御する実験には不向きです。
- 細胞株の選択肢が限られており、(レンチウイルスによる)形質導入が困難な細胞には不向きです。
dCas9-VPR安定的発現細胞株への化学合成ガイドRNAの一過性トランスフェクション/エレクトロポレーション
- ガイドRNAの導入タイミングを調整することで、CRISPRa効果の開始を制御することが可能です。
- dCas9-VPRレンチウイルスによる導入に対応できる細胞株に限定されます。ガイドRNAは最終的に分解され、CRISPRa効果は終了します。
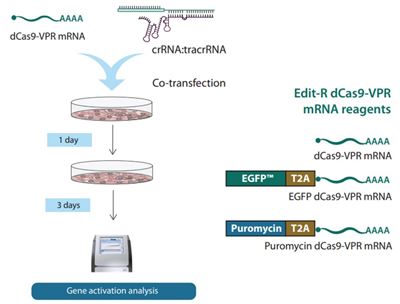
dCas9-VPRをコードするmRNAと化学合成ガイドRNAの一過性トランスフェクション(Figure 1参照)
- 外来DNAを導入せず、ゲノムに恒久的な変化を与えません。
- CRISPRaの全成分の発現を厳密に制御します。
- mRNAとガイドRNAは最終的に分解されるため、短時間でのアッセイが可能です。
- 形質導入が困難な細胞に適したオプションです。
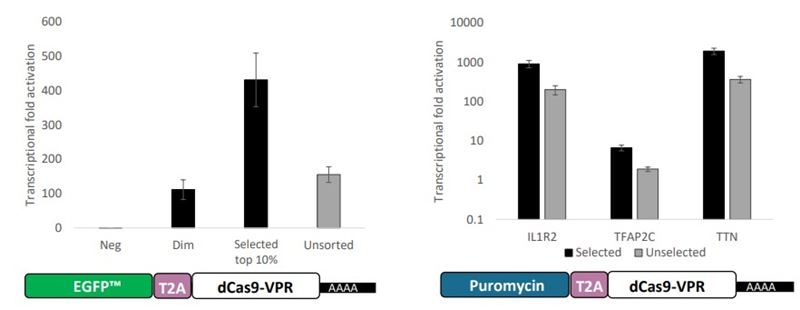
dCas9-VPR mRNAと化学合成ガイドRNAを組み合わせを用いた最終的なCRISPRa遺伝子過剰発現現象は、翻訳開始、RNP形成、RNA崩壊(mRNAとガイドRNAは異なる速度で崩壊する可能性がある)の細胞内動態の混合によって時間的に支配されます。標的遺伝子を活性化するためには、ガイドRNAは核内でdCas9-VPRタンパク質と複合体化しなければなりません。そのためには、mRNAが細胞質で翻訳され、ガイドRNAと複合体化し、ゲノムの標的まで到達しなければなりません。細胞質内のRNAは、その構成と化学修飾に応じた速度で最終的に崩壊するので、mRNAとガイドRNAはおそらく異なる細胞寿命に遭遇するでしょう。そのため、このような複雑な一過性の実験では、遺伝子活性化の出現と衰退を予測することは難しいです。さらに、クローン性のdCas9-VPR発現細胞株は採用されないので、効果の均一性(集団浸透性)はは不確かとなります(ただし、蛍光マーカーや抗生物質耐性を共発現したmRNAを用いて濃縮することは可能です[Figure 2])。
このため、我々はmRNAや化学合成ガイドRNAを用いた遺伝子活性化実験に興味を持つ人々のためのリソースを開発しました。以下に2つのアプリケーションノートのキーポイントを示します。
dCas9-VPR-EGFP mRNAを用いたCRISPRa誘導標的過剰発現の期間:ここでは、dCas9-VPR-EGFP mRNAとターゲットガイドRNAを共導入した場合の、モデル細胞株におけるdCas9-VPR翻訳のタイムラインと動態を示します。同じ細胞で、標的遺伝子のmRNAとタンパク質の過剰発現のタイムラインも示しました。このような共導入実験により、導入後2日以内に標的遺伝子産物の制御可能で、迅速かつ強固な過剰発現が可能になることがわかりました。重要なことは、研究した標的遺伝子について、発現は4-7日以内に基礎レベルに戻り、標的遺伝子過剰発現の前、発現中、発現後の細胞を分析することが可能になることであす。リンクからアプリケーションノートの全文をお読みください。
dCas9-VPR-EGFP mRNAを用いたCRISPRa誘導標的遺伝子過剰発現の集団浸透率:上記と同じターゲットと細胞株を用いて、CRISPRa実験における浸透度、すなわち研究対象の現象を示す細胞の程度を評価しました。注目すべきは、研究中の2つのターゲットについて、ほぼ完全な表現型の浸透性があったことで、これはdCas9-VPRが安定に産生された並行実験と一致していました。リンクからアプリケーションノートの全文をお読みください。
