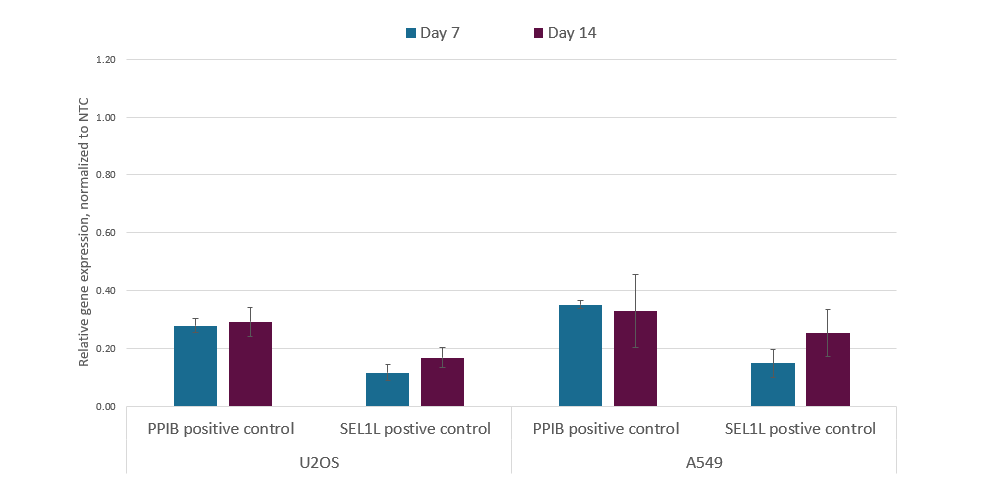- CRISPRi (CRISPR interference) 試薬
- CRISPRi lentiviral sgRNA
CRISPRmod CRISPRi lentiviral sgRNA
ヒト遺伝子の効率的な転写抑制のためのデザイン済みCRISPRiレンチウイルスsgRNA
- トランスフェクションが困難な細胞、または長期間の転写抑制が必要な実験のためのCRISPRiの理想的なデリバリー方法
- 高力価レンチウイルス粒子またはグリセロールストックとして利用可能

CRISPRi lentiviral sgRNA
1Start Here
2Choose
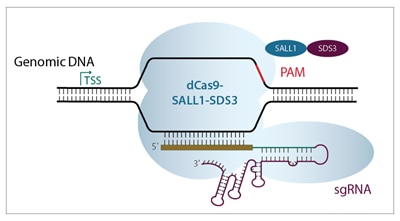
CRISPRiによる効率的な内在性遺伝子転写抑制
CRISPR interference(CRISPRi)は、CRISPR-Cas9遺伝子編集システムを改変したものです。HorizonのCRISPRmod CRISPRiシステムは、独自の転写リプレッサー(SALL1およびSDS3)に融合された触媒活性が不活化されたCas9(dCas9)を利用します。転写開始部位(TSS)のすぐ下流の遺伝子を標的とするアルゴリズム設計のガイドRNAと組み合わせると転写抑制が促進されます。
テクノロジーの概要はCRISPRiアプリケーションのページをご確認ください。
CRISPRi lentiviral sgRNA試薬のハイライト
- グリセロールストックまたは高力価精製レンチウイルス粒子として利用可能です。
- Horlbeckら(2016)によって公開されたアルゴリズムを使用して設計されています。最適化された設計が強力なレベルの遺伝子転写抑制を実現しています。
- 精製/濃縮された高力価レンチウイルス粒子は、トランスフェクションが困難な細胞に直接形質導入することができます。
lentiviral sgRNAを使用したCRISPRi実験に必要な試薬
- ターゲット遺伝子のCRISPRi lentiviral sgRNA
- CRISPRi dCas9-SALL1-SDS3 lentiviral particles(ワークフローを参照)
CRISPRi lentiviral sgRNAベクターマップ
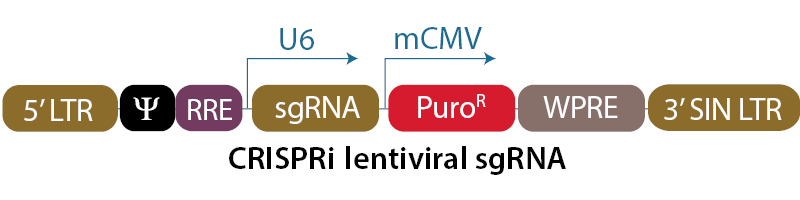
CRISPRi lentiviral sgRNAベクターバックボーンでは、遺伝子特異的ガイドRNAはヒトU6プロモーターの制御下で発現します。ピューロマイシン耐性遺伝子(PuroR)の発現はマウスCMVプロモーターから駆動され、sgRNAが組み込まれた細胞の迅速な選択を可能にします。プラスミドには、大腸菌での増殖と選択のためのAmpR耐性マーカーが含まれています。
CRISPRi lentiviral sgRNAワークフロー
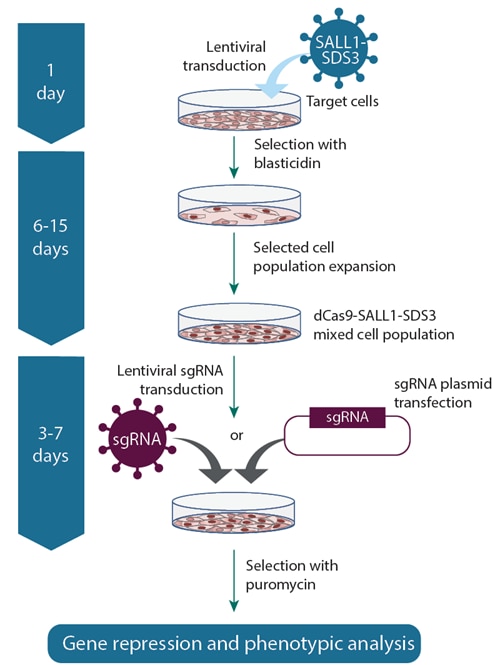
CRISPRi dCas9-SALL1-SDS3 lentiviral particlesを使用して安定したdCas9-SALL1-SDS3発現細胞株を確立し、CRISPRi lentiviral sgRNA particles(左)またはplasmid sgRNA(右)を導入するワークフローです。
CRISPRiコントロール
CRISPRi lentiviral sgRNAポジティブコントロール
- 十分に特徴付けられた遺伝子を標的とするCRISPRi sgRNAを用いて、最大の発現抑制を得るための実験条件の検討を行います。
CRISPRi lentiviral sgRNA non-targetingコントロール
- ターゲット特異的sgRNAの非存在下でCRISPRiコンポーネントに対するベースライン細胞応答を評価するためのCRISPRi non-targetingコントロールです。
関連試薬
CRISPRi dCas9-SALL1-SDS3
- ヌクレアーゼ不活性化Cas9を発現するレンチウイルス粒子またはmRNAは、当社独自の転写抑制因子に融合しています。
CRISPRiレンチウイルスsgRNAは長時間転写抑制に最適である
dCas9-KRABまたはdCas9-SALL1-SDS3を安定して発現するU2OSおよびA549細胞を、24ウェルプレートに50,000細胞/ウェルでプレーティングし、PPIBあるいはSEL1LをターゲットとするCRISPRi sgRNA lentiviral particlesをMOI 0.3で形質導入して、単一のインテグラントを含む細胞を得ました。細胞を2µg/mLピューロマイシンで5日間選択培養し、2つの集団に分割し、さらに1日回復培養しました。形質導入の7日後に、RT-qPCR分析のために1つの細胞集団を回収しました。もう1つの複製集団は、回収前にさらに7日間培養しました。回収したプレートから全RNAを単離し、ハウスキーピング遺伝子としてGAPDHを用いたΔΔCq法で相対的な遺伝子発現を計算し、non-targetingコントロールに対して正規化しました。
- M. A. Horlbeck et al., Compact and highly active next-generation libraries for CRISPR-mediated gene repression and activation. eLife. 5, e19760 (2016).
LentiBOOST Lentivirus Transduction Enhancer is a uniquely formulated transduction reagent that can be used with or without lentivirus spinfection in order to increase successful viral transduction events while preserving cell viability. Especially critical for preserving precious primary cells from patient cohorts, or, for engineering complex animal models; improving transduction efficiency can save time and costs by increasing the success of each editing/transduction step, or, even avoid the loss of irreplaceable samples. Additionally, LentiBOOST technology is already used in the manufacturing of a number of clinical stage therapies providing the opportunity to demonstrate improved workflow applicability to the clinic.
LentiBOOST can be purchased through the Dharmacon Reagents catalog.
To learn more about LentiBOOST technology visit the Revvity LentiBOOST webpage.
Supporting Data
Improved CD8+ T-cell SMARTvector™ shRNA lentiviral system transduction using LentiBOOST™ Lentivirus Transduction Enhancer
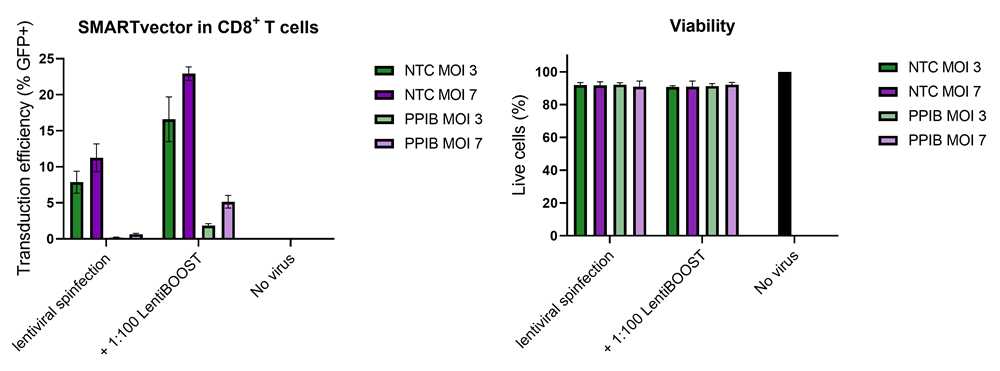
100,000 primary human CD8+ T cells were transduced with either 30,000 (MOI 3, green) or 70,000 (MOI 7, purple) TUs of SMARTVector™ mCMV tGFP Lentiviral Control Particles targeting either NTC or PPIB along with 1:100 LentiBOOST transduction enhancer. Cells were centrifuged at 800 x g for one hour at 32 °C followed by a four hour incubation prior to removal of lentiviral particles and transduction enhancer. Transduction efficiency (%GFP+ out of live cells) and viability were determined 5 days post-transduction by flow cytometry. The addition of LentiBOOST technology markedly improved transduction efficiencies without significantly impacting cell viability.
Improved CD4+ and CD8+ T-cell Edit-R™ All-in-one sgRNA/Cas9 lentiviral system transduction using LentiBOOST™ Lentivirus Transduction Enhancer
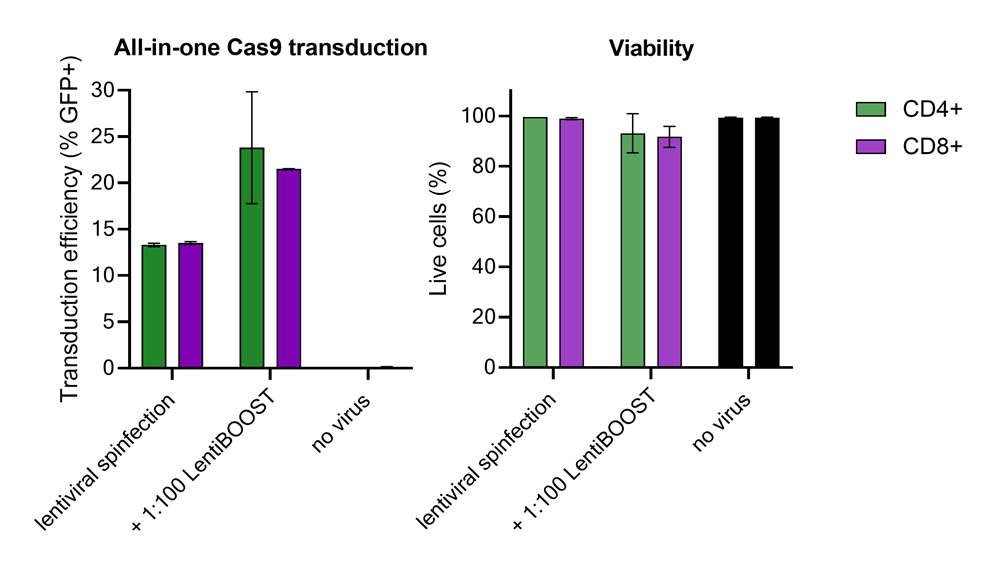
100,000 primary human CD4+ and CD8+ T cells from two donors were transduced with 250,000 TUs of Edit-R GFP Delivery controls mCMV along with 1:100 LentiBOOST transduction enhancer. Cells were centrifuged at 800 x g for one hour at 32 °C followed by an overnight incubation prior to removal of lentiviral particles and transduction enhancer. Transduction efficiency and viability were determined 72 hours post-transduction by flow cytometry. The addition of LentiBOOST technology markedly improved transduction efficiencies without significantly impacting cell viability.
Improved transduction of human induced pluripotent stem cells (hiPSCs) with the Strict-R™ Inducible CRISPRa lentiviral system transduction using LentiBOOST™ Lentivirus Transduction Enhancer

10,000 WTC hiPS cells were transduced with either 20,000 (MOI 2, green) or 40,000 (MOI 4, purple) TUs of Strict-R™ Inducible EGFP dCas9-VPR Lentiviral Particles along with 1:100 LentiBOOST transduction enhancer. Cells were centrifuged at 800 x g for one hour at 32 °C followed by an overnight incubation prior to removal of lentiviral particles and transduction enhancer. Transduction efficiency and viability were determined 72 hours post-transduction by flow cytometry. The addition of LentiBOOST markedly improved transduction efficiencies without significantly impacting cell viability.
Product inserts
Safety data sheets
Technical manuals
Related Products
遺伝子転写抑制実験の最適化のための検証済みCRISPRi lentiviral sgRNA
LentiBOOST transduction enhancer can increase successful viral transduction in challenging to transduce cells, or, complex cellular engineering work; while preserving cell viability and minimizing the amount of viral particles required for your experiment. LentiBOOST technology is actively used in the production of clinical stage lentivirally delivered therapies, including some approved therapies, providing a direct path to therapeutic applicability for your research studies. Tested with Dharmacon Lentiviral reagents.