Edit-R HDRプラスミドドナープライマー
Edit-R Plasmid Donor KitsのPCRコンポーネント

HDRドナープラスミドが適切に組み立てられ、DNAドナーとして使用できることを確認することは重要です。Edit-R HDR DNAドナープラスミドコロニーPCRプライマーペアは、Edit-R HDRプラスミドドナーキットに含まれているコンポーネントであり、5'および3' 相同性アームが完成したドナーテンプレートプラスミドに適切に挿入されていることを確認するために使用されます。バックボーン、インサート、および2つの相同性アームからのEGFPまたはmKate2 DNAドナープラスミドの組み立て後、PCR反応は、バックボーンからインサート領域までの2つの相同性アームにわたって実行され、適切な組み立てと方向性を確認します。カスタム配列を含むドナープラスミドの組み立てを確認するために、1回のPCR反応で相同性アームとインサートの両方を含む領域全体を増幅します。
Highlights
- DNAドナープラスミドを迅速かつ効率的に組み立てます。
- ドナープラスミドの設計、組み立て、および確認のための検証済みプロトコールが提供されます。
- CRISPR Design Toolを利用して、切断部位へのcrRNAを設計できます。
- 挿入部位を挟む5 'および3'相同性アームを作成するためのプライマー設計用のHDR Donor Designerとシームレスに統合されています。
構成と容量
| Cat # | Description | Item# | Amount |
|---|---|---|---|
| UK-008100-PP-05 | Edit-R HDR DNA Donor Plasmid Colony PCR Primer Pair - EGFP | ||
| Edit-R Colony PCR Primer EGFP Forward | U-008100-FB-05 | 5 nmol | |
| Edit-R Colony PCR Primer EGFP Reverse | U-008100-RA-05 | 5 nmol | |
| UK-008200-PP-05 | Edit-R HDR DNA Donor Plasmid Colony PCR Primer Pair - mKate2 | ||
| Edit-RColony PCR Primer mKate2 Forward | U-008200-FB-05 | 5 nmol | |
| Edit-RColony PCR Primer mKate2 Reverse | U-008200-RA-05 | 5 nmol | |
| UK-008300-PP-05 | Edit-RHDR DNA Donor Plasmid Colony PCR Primer Pair - Universal | ||
| Edit-RColony PCR Primer Backbone Forward | U-008300-FW-05 | 5 nmol | |
| Edit-RColony PCR Primer Backbone Reverse | U-008300-RV-05 | 5 nmol |
Note:コロニーPCRプライマーはHDR プラスミドドナーキットに含まれています。コロニーPCRプライマーのみをより多く必要な場合には、本Edit-R HDR plasmid donor primersを注文してください。
U2OS細胞においてN末端がEGFPでタグ付けされたLMNAとN末端がmKate2でタグ付けされたSEC61B
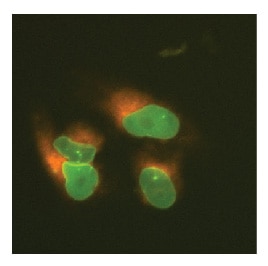
U2OS細胞に、Cas9 mRNA、LMNAを標的とする化学合成crRNA:tracrRNA、SEC61Bを標的とする化学合成crRNA:-tracrRNA、相同性アームあたり約1000 bpの相同性を含むLMNAのN末端に特異的なEGFPドナープラスミド、および相同性アームあたり約1000 bpの相同性を含むSEC61BのN末端に特異的なmKate2ドナープラスミドを、DharmaFECT Duoを用いてトランスフェクトしました。必要に応じて細胞を継代し、トランスフェクションの7日後にInCell 2200ハイコンテント蛍光顕微鏡で画像化して、EGFPとmKate2の両方が挿入された単一細胞を同定しました。
コロニーPCRによる成功したクローニングの検出
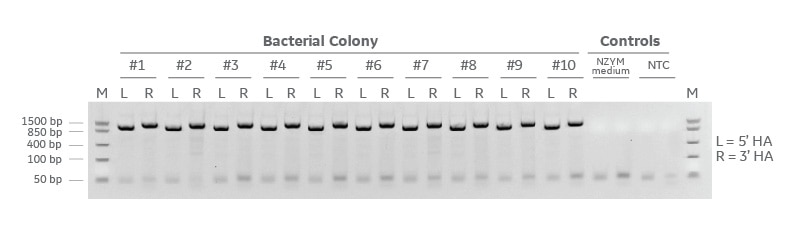
ユニバーサルバックボーン、EGFPインサート、および2つのPCRで生成された相同性アームを備えたEdit-Rドナープラスミドキットのギブソンクローニング結果。得られたクローニング反応をNEB 5-αケミカルコンピテントセルで形質転換し、37℃で一晩増殖させました。10個の細菌コロニーをランダムに選択し、コロニーPCRを実行して、各相同性アーム(L = 5' 相同性アームおよびR = 3' 相同性アーム)の存在を検出しました。コロニーPCRアンプリコンは、エチジウムブロマイドとFastRuler低分子量分子量マーカーを含む2%アガロースE-ゲルで実施しました。
HDRプラスミドドナーのクローニングに必要な材料
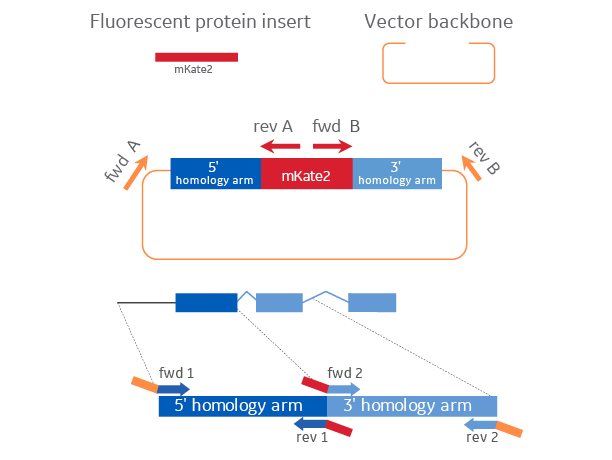
Edit-R HDRプラスミドドナーは、蛍光タンパク質インサート配列、カットベクターバックボーン、挿入部位を挟むゲノム領域に対して設計したカスタムPCRプライマーを用いて生成された2つの相同性アームの組み立てによって作製されます。
プラスミドドナークローニングワークフロー
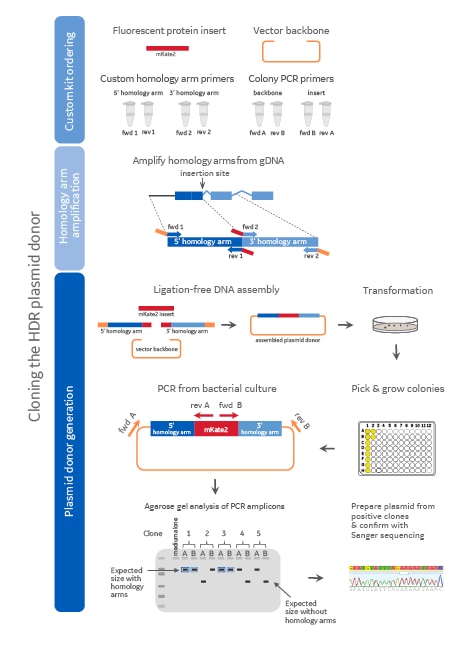
コンポーネントの順序付け、相同性アームの増幅、およびプラスミドドナーの生成を含むプラスミドドナーのクローニングワークフロー。図の色は、DNAの起源を示しています(濃青 = 5' 相同性アーム、水色 = 3' 相同性アーム、赤 = mKate2蛍光レポーター配列、オレンジ = プラスミドバックボーン)。medium alone = 培地のみのネガティブPCRコントロール
mKate2ノックインクローン細胞株を作製するためのワークフロー
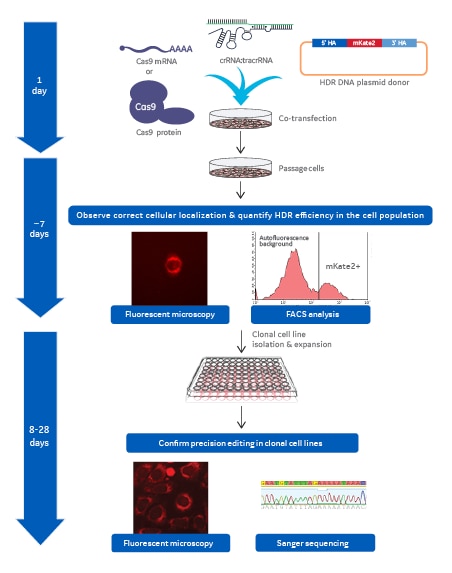
mKate2ノックインクローン細胞株を作製するために必要な主要なプロセスステップと一般的なタイミングを示すワークフロー
Edit-R mKate2ノックインドナー
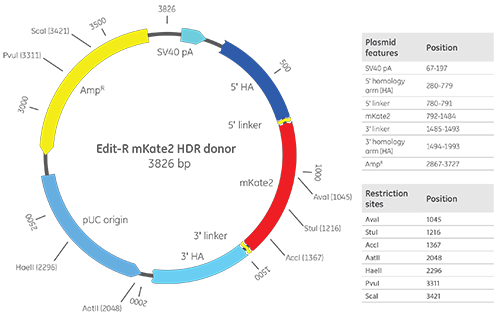
Edit-R mKate2プラスミドドナーマップと重要なベクター機能。この図では、例として500 bpの相同性アームが含まれています。
陽性クローンの配列検証
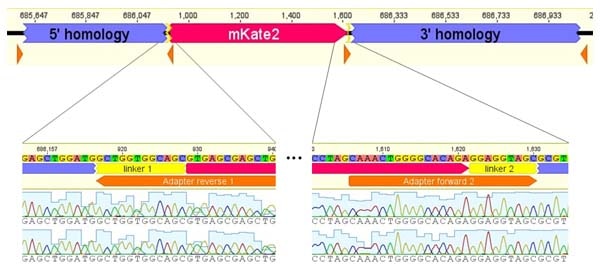
コロニーPCRに続いて、サンガーシーケンシングを利用して陽性クローンの配列を確認しました。
