- CRISPRa (CRISPR activation) 試薬
- CRISPRa化学合成crRNAポジティブコントロール
CRISPRmod CRISPRa synthetic crRNA(化学合成crRNA)ポジティブコントロール
遺伝子転写活性化実験の最適化のための検証済みの化学合成プールフォーマットまたは個別のcrRNA

CRISPRaポジティブコントロールは、よく特徴付けられたヒトまたはマウスの遺伝子を選択的に転写活性化します。ポジティブコントロールは、標的遺伝子特異的なガイドRNAを用いた実験の前に、デリバリー条件とdCas9-VPR発現の、最適化と継続的なモニタリングに推奨されます。
実行される転写活性化のレベルは、細胞の種類と発現のベースレベルによって異なります。non-targetingコントロールへの活性化レベルの正規化は、そのアッセイの最適なdCas9-VPR発現、トランスフェクション効率、およびタイムポイントを決定するためのベースラインを提供します。
Highlights
- ヒトまたはマウスのTitin(TTN)またはPOU class 5 homeobox 1(POU5F1)をご用意しています。
- 実験条件の最適化、および遺伝子転写活性化が確実に実施されたことを確認するために使用します。
注意:CRISPRa化学合成crRNA試薬は、tracrRNA と組み合わせて用います。
| crRNA nmol | tracrRNA nmol | 96-well plate 100 µL volume | 24-well plate 500 µL volume | 12-well plate 1000 µL volume | 6-well plate 2500 µL volume |
|---|---|---|---|---|---|
| 2 | 2 | 800 | 160 | 80 | 32 |
| 5 | 5 | 2000 | 400 | 200 | 80 |
| 10 | 10 | 4000 | 800 | 400 | 160 |
| 20 | 20 | 8000 | 1600 | 800 | 300 |
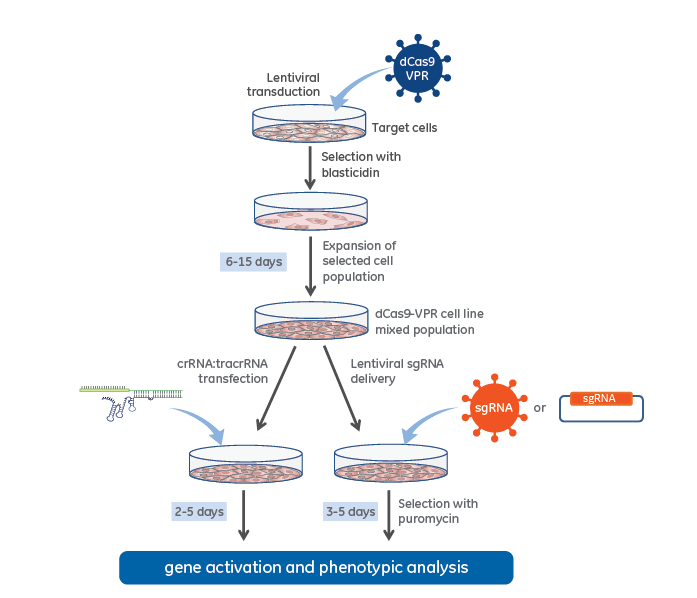
dCas9-VPR安定発現細胞株を使用したCRISPRaワークフロー
Lentiviral dCas9-VPRと化学合成crRNA:racrRNA(左側)または lentiviral expressed sgRNA(右側)を使用したCRISPR activationワークフロー
複数のdCas9-VPR安定発現細胞株におけるCRISPRa化学合成crRNA:tracrRNAによる効率的な遺伝子の転写活性化
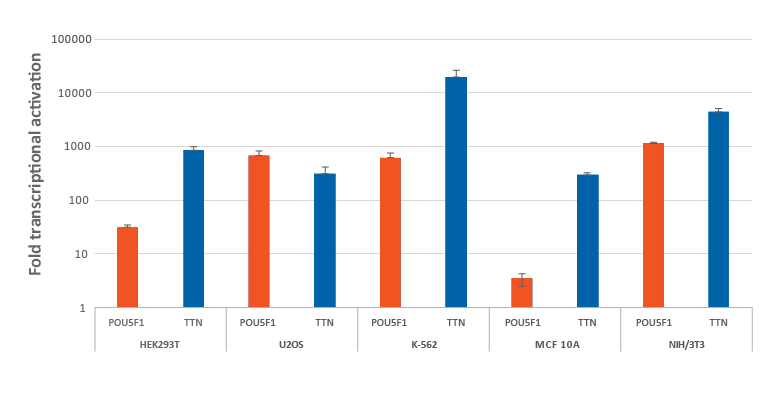
CRISPRa dCas9-VPRを安定発現するように改変されたHEK293T、U2OS、MCF 10A、NIH/3T3を10,000細胞/ウェルでプレーティングし、DharmaFECTトランスフェクション試薬を使用して、POU5F1およびTTNを標的とするCRISPRa化学合成crRNA:racrRNA(25 nM)をトランスフェクトしました。K562細胞には、POU5F1およびTTNを標的とするCRISPRa化学合成crRNA:tracrRNA(400 nM)をエレクトロポレーションしました。トランスフェクションの72時間後に細胞を回収し、RT-qPCRを使用して相対的な遺伝子発現を測定しました。各遺伝子の相対的な転写活性化倍率は、ハウスキーピング遺伝子としてGAPDHを使用するCq法で計算し、non-targetingコントロールに対して正規化しました。
CRISPRaによる転写活性化倍率は遺伝子によって異なり、内在性遺伝子発現レベルに依存する
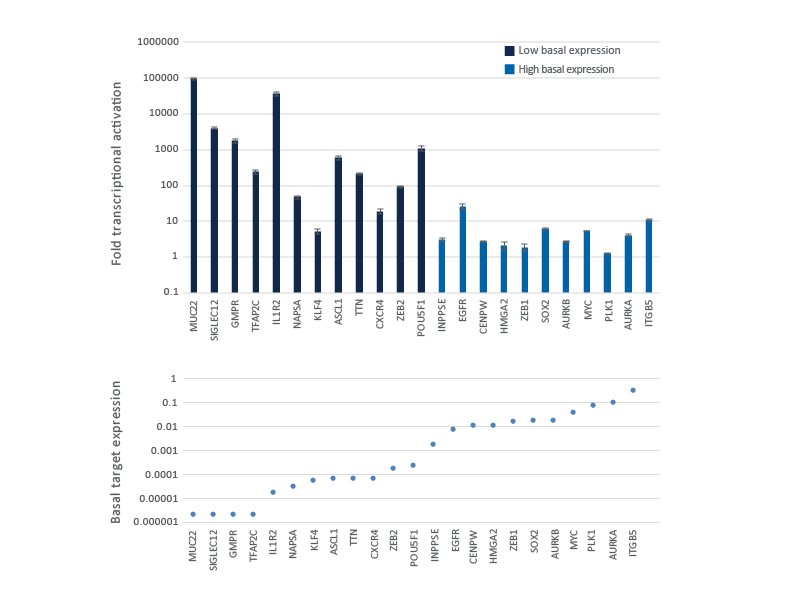
基礎発現が低いかまったくない遺伝子は、強力なレベルまで活性化するのが簡単ですが、すでに高レベルで発現している遺伝子は、さらに過剰発現することはより困難です。dCas9-VPRを安定発現するように改変されたU2OS細胞を10,000細胞/ウェルでプレーティングし、DharmaFECT 4トランスフェクション試薬を使用して、異なる基礎発現レベルの23種類の遺伝子を標的とするCRISPRa化学合成crRNA:tracrRNAプール(25 nM)をトランスフェクトしました。トランスフェクションから72時間後に細胞を回収し、相対的な遺伝子発現を、RT-qPCRを使用して測定しました。CRISPRaを介した転写活性化の倍数は上のグラフに示しました。ここでは、NTCコントロールで処理されたサンプルにおける基本的な転写産物の発現レベルが低いものから高いものへと遺伝子が並べられています。下のグラフには、GAPDHコントロールと比較した標的遺伝子の基礎発現を示しています。
CRISPRaによる遺伝子の転写活性化は24時間で観察され、48〜72時間でピークに達する
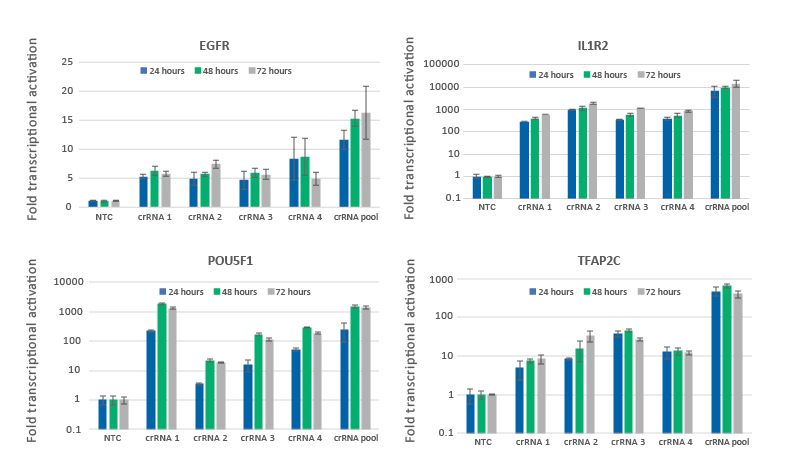
dCas9-VPRを安定発現するように改変されたU2OS細胞を10,000細胞/ウェルでプレーティングし、DharmaFECT 4トランスフェクション試薬を使用して、EGFR、IL1R2、POU5F1、またはTFAP2Cを標的とするCRISPRa化学合成crRNA:tracrRNAをトランスフェクトしました。4種類のデザイン済みCRISPRa crRNAを個別またはプールフォーマットで使用しました(合計濃度:25 nM)。トランスフェクションの24、48、72時間後に細胞を回収し、RT-qPCRを使用して相対的な遺伝子発現を測定しました。各遺伝子の相対的発現は、ハウスキーピング遺伝子としてGAPDHを使用するCq法で計算し、non-targetingコントロールに対して正規化しました。
CRISPRa用量曲線は、25 nMの作業濃度で非常に効果的な遺伝子転写活性化を示す
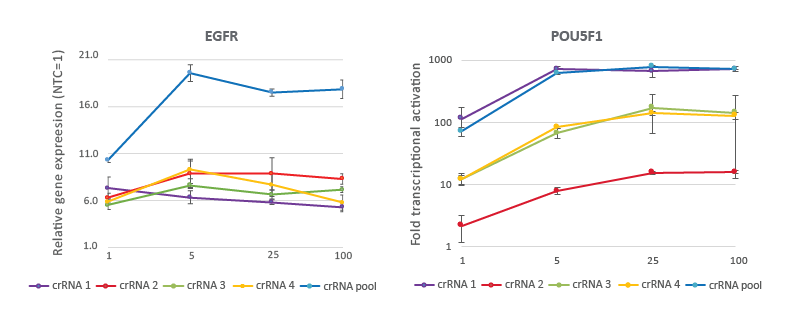
dCas9-VPRを安定発現するように改変されたU2OS細胞を10,000細胞/ウェルでプレーティングし、DharmaFECT 4トランスフェクション試薬を使用して、EGFRまたはPOU5F1を標的とするCRISPRa化学合成crRNA:tracrRNAをトランスフェクトしました。デザイン済みCRISPRa crRNAは、個別、または4つの濃度(1、5、25、100 nM)のプールフォーマットで使用しました。トランスフェクションの72時間後に細胞を回収し、RT-qPCRを使用して相対的な遺伝子発現を計算しました。各遺伝子の相対的発現は、ハウスキーピング遺伝子としてGAPDHを使用するCq法で計算し、non-targetingコントロールに対して正規化しました。
Application notes
Protocols
Safety data sheets
Related Products
標的遺伝子特異的crRNAの非存在下でCRISPRaコンポーネントに対するベースライン細胞応答を評価するためのnon-targetingコントロール
CRISPR activationを使用したヒトおよびマウス遺伝子の過剰発現のためのデザイン済み化学合成ガイドRNA