Add any of our CRISPR portfolio reagents (CRISPRko, CRISPRa, CRISPRi) to your cart to see reduced pricing effective in 2025
あらゆるCRISPRゲノム編集ワークフローのためのCas9ヌクレアーゼソリューション
Dharmacon™は、CRISPRゲノム編集アプリケーションのためのさまざまなCas9ヌクレアーゼソリューションを提供しています。
Edit-R™ CRISPR-Cas9ゲノム編集アプリケーションについて詳しくはこちらをご参照ください。
合理化されたゲノム編集実験のためのCas9安定発現細胞株
汎用のさまざまな細胞タイプの’CRISPR-ready’のCas9安定発現細胞株をご利用いただければ、短い期間でゲノム編集実験を行うことができます。
最適化または濃縮のための蛍光Cas9試薬
mKate2またはTurboGFP™のいずれかをCas9と共発現するレンチウイルスまたはmRNA試薬を用いて、Cas9発現細胞の濃縮を簡素化します。
DNA-freeの遺伝子ノックアウト実験のための一過的なCas9製品
一過的にCas9発現を可能にするmRNAまたはタンパク質試薬を用いて、オフターゲットを減らし、潜在的で望ましくない細胞応答から細胞を保護します。
あらゆる細胞型への容易な導入のためのレンチウイルスCas9
構成的または誘導的レンチウイルスCas9試薬を用いて、細胞毒性のあるトランスフェクションやエレクトロポレーションステップを回避できます。
Cas9ヌクレアーゼ選択ガイド
実験に最適なCas9ヌクレアーゼ試薬の決定は、アプリケーションまたは細胞の種類によって異なります。表をご参考になり、実験に最適なフォーマットをご決定ください。
| Cas9 protein | Cas9 mRNA | Lentiviral Cas9 particles | |
|---|---|---|---|
| DNA-free、一過的発現 | ✔ | ✔ | |
| 化学合成ガイドRNAとのコエレクトロポレーション | ✔ | ✔ | |
| 化学合成ガイドRNAとのコトランスフェクション | ✔ | ✔ | |
| FACSによる細胞濃縮 | ✔ | ✔ | |
| 耐性マーカーによる細胞濃縮 | ✔ | ||
| 誘導的発現 | ✔ | ||
| 安定した細胞株の作製 | ✔ | ||
| 導入が困難な細胞へのレンチウイルス導入 | ✔ |
Cas9安定発現細胞のご注文
Cas9発現細胞株
機能喪失研究用のCRISPRガイドRNAを導入する準備ができている細胞株です。汎用されるさまざまな細胞タイプのCas9安定発現細胞株をご用意しています。
一過的Cas9ヌクレアーゼのご注文
Cas9 mRNA
ソーティング、濃縮、可視化に利用できる蛍光オプションも選択できる一過的なCas9ヌクレアーゼ発現のための精製Cas9mRNA
Cas9タンパク質NLS
迅速なRNPワークフローのためのready-to-useの精製Cas9タンパク質
ベクターベースのCas9のご注文
Lentiviral Cas9
Cas9安定発現細胞を作製するための精製レンチウイルス粒子またはプラスミドDNA。誘導的プロモーターも選択可能です。
Not sure where to start?
Contact an expertCas9 mRNAデータ
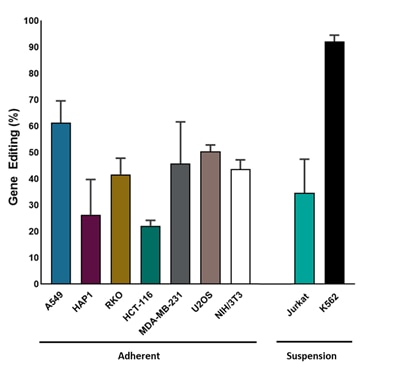
Cas9安定発現細胞株にEdit-R化学合成sgRNAを用いた効率的なindel形成
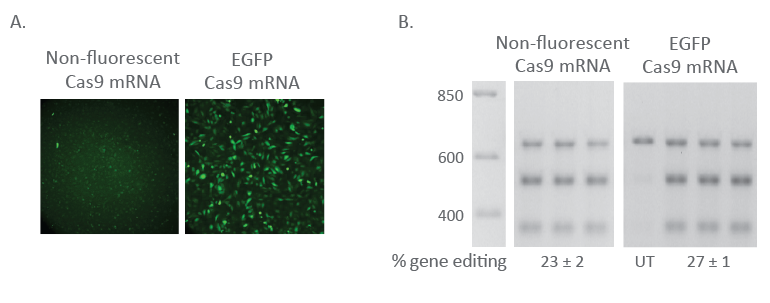
蛍光Cas9 nuclease mRNAは編集効率を維持する
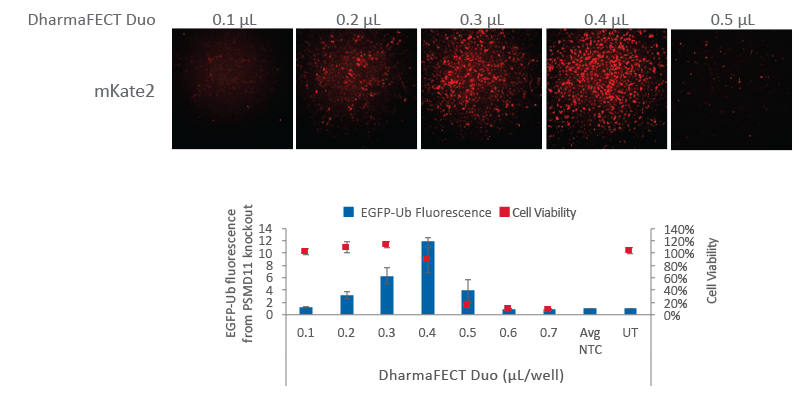
蛍光Cas9 nuclease mRNAは最適なトランスフェクション条件を示す
Cas9 proteinデータ
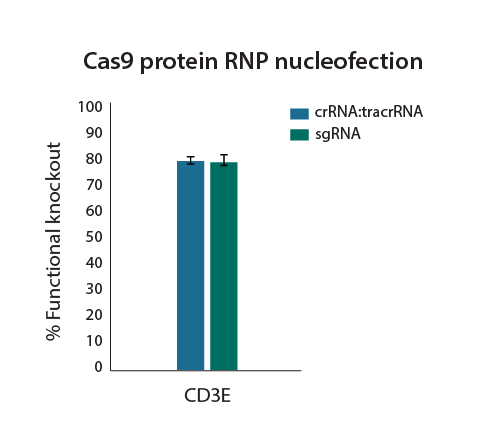
化学合成ガイドRNAとCas9ヌクレアーゼタンパク質をRNPとしてエレクトロポレーション
Lentiviral Cas9データ
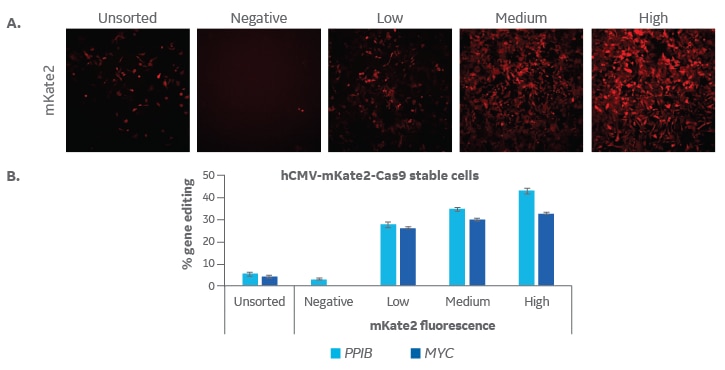
蛍光Lentiviral Cas9ヌクレアーゼにより、高発現細胞の濃縮とCRISPR-Cas9ゲノム編集効率の向上が可能
Cas9ヌクレアーゼ
‘CRISPR-ready’の改変済みCas9発現細胞株
-
Cas9安定発現細胞株
機能喪失研究用のCRISPRガイドRNAを導入する準備ができている細胞株です。汎用されるさまざまな細胞タイプのCas9安定発現細胞株をご用意しています。
DNA-freeワークフローのための一過的なCas9ヌクレアーゼ
-
Cas9 nuclease mRNA
Cas9ヌクレアーゼの一過的な発現用に精製されたCas9 mRNAです。ソーティング、濃縮、視覚化に利用できる蛍光オプションも選択可能です。
-
Cas9 nuclease protein NLS
DNA-freeの実験ワークフローのためのready-to-useの精製Cas9タンパク質です。
Cas9発現細胞株を作製するためのベクターベースのソリューション
-
Lentiviral Cas9 nucleases試薬
Cas9ヌクレアーゼ安定発現細胞株を作製するための精製レンチウイルス粒子またはプラスミドDNAです。構成的または誘導的プロモーターを選択可能です。
CRISPR ガイドRNA
Edit-R化学合成ガイドRNAおよびコントロール
-
Synthetic sgRNA(化学合成sgRNA)
目的の遺伝子を編集(DNA切断)することが保証されたゲノムワイドにご用意しているデザイン済み化学合成sgRNAです。デザインアルゴリズムは、厳密な特異性チェックを通じてオフターゲット編集を最小限に抑えながら、機能的なタンパク質ノックアウトの可能性を最大化します。
-
化学合成sgRNAポジティブコントロールおよび検出プライマー
十分に特徴付けられた遺伝子を標的とする種特異的な化学合成sgRNAおよびミスマッチ検出アッセイプライマーであり、ゲノム編集効率を最大化する実験条件を検討するために使用します。
-
化学合成sgRNA non-targetingコントロール
標的遺伝子特異的sgRNAの非存在下でCRISPR-Cas9コンポーネントに対するベースラインの細胞応答を評価するために使用します。
-
-
Synthetic crRNA(化学合成crRNA)
標的遺伝子の編集(DNA切断)が保証されています。アルゴリズムで最適化されたcrRNAであり、ヒトおよびマウスの遺伝子をゲノムワイドに網羅しています。ヌクレアーゼ耐性の向上のために、化学修飾が導入されています。
-
化学合成tracrRNA
Trans-activating CRISPR RNA(tracrRNA)は、化学合成crRNAと組み合わせて用い、Cas9ヌクレアーゼによる編集を行う「ガイドRNA複合体」を形成します。
Edit-RレンチウイルスsgRNA&コントロール
-
all-in-one e lentiviral sgRNA + Cas9
Cas9とsgRNAを一つのベクターから発現させ、効率的な遺伝子ノックアウトと高い特異性を実現します。グリセロールストックおよび高力価精製レンチウイルス粒子をご用意しています。
-
all-in-one lentiviral sgRNAポジティブコントロールおよびキット
all-in-one lentiviral sgRNA用コントロールにより、DNA二本鎖切断とゲノム編集効率を検証します。
-
all-in-one lentiviral sgRNA non-targetingコントロール
ヒト、マウス、またはラットのゲノム内の遺伝子を標的としないようにバイオインフォマティクスによって設計および検証されているall-in-one lentiviral sgRNAコンストラクトです。
-
-
Lentiviral sgRNA
アルゴリズムで最適化されたsgRNAであり、ヒトまたはマウスの遺伝子をゲノムワイドに網羅しています。目的の標的遺伝子の編集(DNA切断)が保証されています。グリセロールストックおよび高力価精製粒子をご用意しています。
-
Lentiviral sgRNAポジティブコントロール
十分に特徴付けられた遺伝子を標的とする種特異的なsgRNAを使用して、ゲノム編集効率を最大化する実験条件を検討するため使用します。
-
Lentiviral sgRNA non-targetingコントロール
標的遺伝子特異的sgRNAの非存在下でCRISPR-Cas9コンポーネントに対するベースラインの細胞応答を評価するために使用します。
-
カスタムガイドRNAデザイン
-
CRISPR Design Tool
配列既知のカスタムガイドRNAを注文するか、使いやすいインターフェースを使用して研究にユニークな化学合成sgRNAやcrRNA、またはレンチウイルスsgRNAをデザインおよび注文できます。
Edit-R HDRドナーテンプレートのデザイン、注文ツールおよびキット
-
HDR Donor Designer - oligo
挿入、欠失、またはその他の改変のための一本鎖DNAドナーオリゴ(≤150nt)をデザインし、注文することができます。
-
HDR Donor Designer - plasmid
mKate2またはEGFP蛍光マーカー、またはカスタムインサートを挿入するためのプラスミドDNAドナーキットをデザインし、注文することができます。
-
HDR plasmid donor kits
HDR用のプラスミドドナーを迅速かつ簡単に組み立てることができます。
-
HDR plasmid donor components
HDRドナープラスミドを迅速かつ効率的に構築します。
-
HDR plasmid donor primers
Edit-R Plasmid Donor KitのPCRコンポーネントのみをご提供しています。
Dharmacon Edit-R保証
すべてのデザイン済みEdit-RガイドRNAは、Edit-Rテクニカルマニュアルの記載に従い細胞導入した場合に、標的領域で編集(DNA切断)ができることを保証されています。
Edit-R ガイドRNA保証は、野生型S. pyogenes 由来Cas9ヌクレアーゼ(タンパク質、mRNA、発現用プラスミド、または発現用レンチウイルスベクター)とともに使用した場合に適用されます。更にEdit-R化学合成crRNAは、Edit-R tracrRNAとともに使用した場合に適用されます。
T7EIまたはSurveyorミスマッチ検出アッセイを使用して、試薬で処理された細胞集団の編集(DNA切断)の分析結果を提示する必要があります。同時並行で適切に実施されたEdit-R ポジティブコントロールが編集(DNA切断)に成功する一方で、Edit-Rデザイン済みガイドRNAによる編集(DNA切断)が成功しない場合、同じフォーマットで同じ容量の、異なるEdit-R デザイン済みガイドRNAの交換製品が、1回限り無償で提供されます。
交換製品の提供は、テクニカルサポートチームとの話し合いでのみ承認されます。
DNAレベルでの編集(切断)の成功は、常に機能的な遺伝子ノックアウトにつながるとは限りません。複数のガイドRNAをテストして、標的遺伝子のノックアウトに最も効果的なガイドRNAを決定することをお薦めします。
この保証は付随する実験費用には適用されず、CRISPR Design Toolを介して注文されたガイドRNAには適用されず、また本保証により交換したガイドRNAには適用されません。

