初代免疫細胞を用いた早期の創薬標的の同定には、業界をリードする再現性と機能的関連性を有するT細胞アレイ化スクリーニングをご活用いただくことで、治療薬開発を促進することができます。
CRISPRノックアウト遺伝子スクリーニングは、治療標的を明らかにし、遺伝的疾患との関連を理解する可能性を提供します。T細胞アレイ化スクリーニングを用いると、in vitro環境において遺伝子抑制が細胞機能に与える影響を詳細に理解することができ、免疫反応に不可欠な複数の遺伝子の相互の関連性を持つ初代免疫細胞を遺伝子操作する際に見られる課題を克服することができる可能性があります。
T細胞アレイ化CRISPRノックアウトスクリーニングとは?
CRISPR-Cas9ゲノム編集技術を用いて、T細胞内の特定の遺伝子を系統的に破壊または "ノックアウト"する特別な遺伝子スクリーニングアプローチです。アレイ化スクリーニングでは、各ウェルでは単一の遺伝子がノックアウトされ、増殖(CTG)、表面および細胞内マーカー(FACS)、タンパク質産生定量(HTRF®)を含むマルチプレックス・リードアウトによる特定遺伝子の詳細な解析が可能です。ハイスループット・プラットフォームが提供する自動化とタイムラインの短縮により、単一遺伝子ノックアウト細胞を下流の機能アッセイに使用することもできます。
T細胞を用いるCRISPRノックアウトの応用
- CRISPRを用いた免疫機能スクリーニングにおける遺伝子機能の解析
- CRISPRでゲノム編集したin vitro免疫モデルにおける化合物の作用機序の評価
- 遺伝子と細胞の表現型の関係性を明らかにし、T細胞の挙動に及ぼす影響の研究
T細胞CRISPRノックアウトスクリーニング・プラットフォーム
CRISPRノックアウト技術とT細胞ImmuSignature™アッセイの信頼性を組み合わせることで、従来のアプローチを超えることができます。この特徴的なサービスの組み合わせにより、当社のT細胞遺伝子スクリーニングの潜在能力を最大限に引き出し、関連するin vitro免疫細胞機能評価とともに堅牢な統計解析を提供し、標的探索の研究を支援します。
- 小型で最適化されたプラットフォームにより、薬剤の表現型への影響を評価することができます。
- 二重特異性(bi-specific)薬剤、低分子化合物、モノクローナル抗体のスクリーニング用に設計されています。
- HTRF®技術によるサイトカイン産生の測定など、機能解析リードアウトへの拡張が可能です。
T細胞を用いるアレイ化CRISPRスクリーニングワークフロー
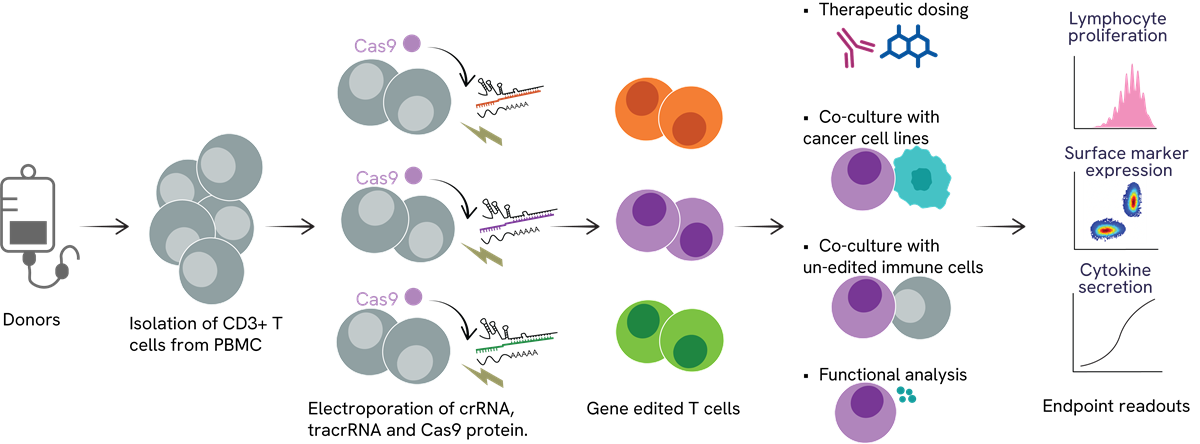
機能評価を伴う半自動のT細胞ゲノム編集プラットフォーム このプラットフォームは、免疫応答における新規遺伝子標的の発見を容易にし、免疫関連疾患における重要遺伝子の標的探索を支援します。アレイ化スクリーニングでは、刺激したT細胞にcrRNA、tracrRNA、Cas9タンパク質をエレクトロポレーションで送達します。編集されたT細胞は、編集されていない免疫細胞や癌細胞株と共培養されるか、治療薬候補と培養されます。各ウェルでの分析には、細胞増殖、表面マーカー発現、サイトカイン産生の測定が含まれます。
編集細胞のT細胞活性化アッセイによる機能解析
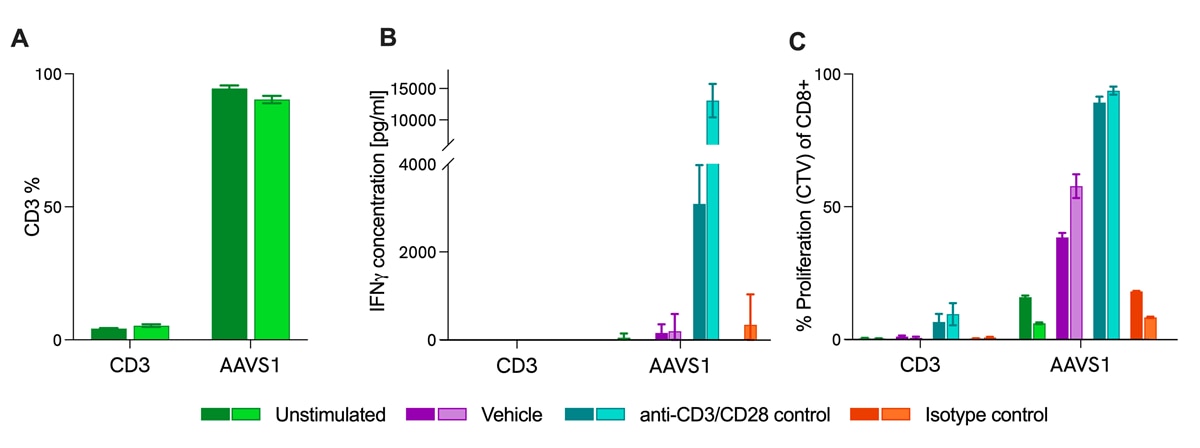
CRISPRノックアウトとImmuSignature™ T細胞活性化(TCA)を組み合わせたプロジェクトにおいて、CD3ノックアウトT細胞はサイトカイン放出と増殖の欠損を示した。アレイ化スクリーニングフォーマットで、ヒトCD3 T細胞にCD3を標的とするCRISPRガイドRNAとCas9タンパク質を送達しました。編集細胞を、ImmuSignature™ T細胞活性化(T cell activation: TCA)アッセイにおいて抗CD3抗体および抗CD28抗体で刺激しました。A) 全リンパ球に対するCD3のノックアウト効率。フローサイトメトリーにより表面マーカー発現率を測定した。B) CD3ノックアウトT細胞のINF-y産生をHTRF®テクノロジーで測定しました。CD3ノックアウトT細胞では産生抑制がみられました。C) CD8+ T細胞の増殖能をCellTrace™ Violetで評価した。CD3ノックアウトT細胞では増殖能抑制がみられました。AAVS1:表現型への影響がなく安全な遺伝子領域であるsafe harbor control、ドナー数:すべての条件においてn=2で評価

