初期段階の医薬品研究において、T細胞機能に重要な遺伝子を迅速に同定することは、免疫関連疾患の標的を効果的に選択するために不可欠です。プール化T細胞スクリーニングにより、生物学的に意味のある状況下で、遺伝子標的の正確な洞察を得て、機能的意義を評価することができます。
プール化スクリーニングは、コスト効率に優れたハイスループットな戦略であり、将来の治療標的を迅速に同定する上で大きな可能性をもたらします。当社のプール化T細胞CRISPRノックアウトスクリーニングは、ゲノム編集におけるコスト、範囲、スピード、再現性、精度における課題を軽減します。T細胞バイオロジーの理解を促進し、潜在的な治療標的を発見していただけます。
T細胞におけるプール化CRISPRノックアウトスクリーニングとは?
T細胞プール内の遺伝子機能を系統的に調べるための強力な方法です。このプロセスでは、幅広い遺伝子のコレクションを標的とするsgRNAライブラリーをデザインし、これらのsgRNAを含むレンチウイルスベクターを初代T細胞に形質導入します。sgRNAに誘導されたCas9酵素が標的遺伝子の二本鎖切断を誘導し、細胞修復の際に遺伝子がノックアウトされます。編集されたT細胞集団を増殖培養した後、増殖(CTG)、表面および細胞内マーカー(FACS)、タンパク質産生定量(HTRF®)、次世代シークエンシングなどのさらにマルチプレックスなリードアウトを用いて、遺伝子ノックアウトがT細胞の挙動に及ぼす影響を評価するための機能アッセイが実施されます。
T細胞を用いるCRISPRノックアウトKOの応用
- 系統的遺伝子探索による治療標的の同定
- CRISPRを用いた免疫機能スクリーニングにおける遺伝子の役割の理解
- CRISPRでゲノム編集したin vitro免疫モデルにおける化合物の作用機序の評価
- 遺伝子と細胞の表現型の関係性を明らかにし、T細胞の挙動に及ぼす影響の研究
プール化CRISPRノックアウトT細胞スクリーニングの特長
プール化アプローチにより、多数の遺伝子の同時評価が可能となり、免疫関連疾患における機能的関連性を有する新規治療標的の発見が加速されることが期待されます。このスクリーニングは、CRISPR技術を活用し、初代T細胞における正確なゲノム編集を可能にすることで、再現性と信頼性を高めています。
- 小型で最適化されたプラットフォームにより、薬剤の表現型への影響を評価することができます。
- 二重特異性(bi-specific)薬剤、低分子化合物、モノクローナル抗体のスクリーニング用に設計されています。
- HTRF®技術によるサイトカイン産生、NGS解析、バイオインフォマティクスなど、共培養や機能的リードアウトなどの下流アッセイへの拡張が可能です。
T細胞を用いるプール化CRISPRスクリーニングワークフロー
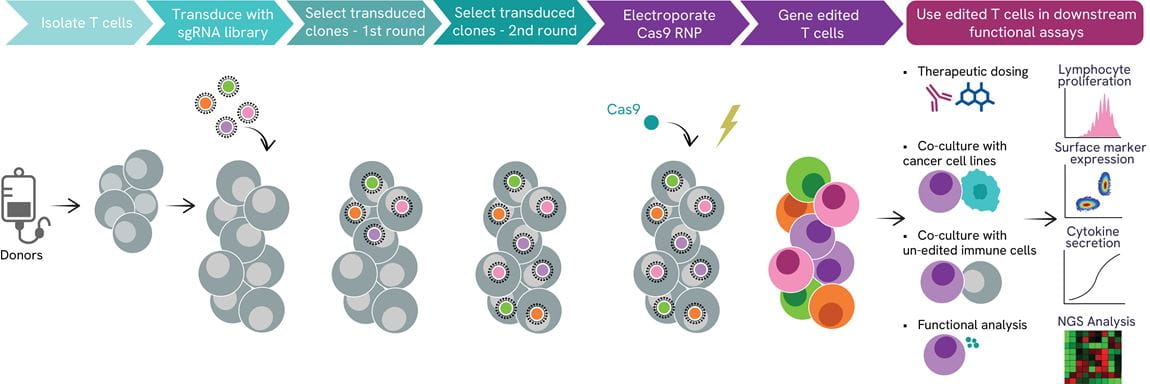
プール化CRISPRノックアウトスクリーニングによるTリンパ球免疫応答に関与する新規遺伝子ターゲットの同定は、単離された初代T細胞を用いる当社のスクリーニング・プラットフォームによって達成することができます。まず、レンチウイルスsgRNAライブラリーを形質導入し、続いてCas9 mRNAが送達されます。編集後、T細胞は編集されていない免疫細胞やがん細胞株と共培養したり、治療薬候補の治療と培養されます。細胞増殖、表面マーカー発現、サイトカイン産生の測定、およびNGSとそのバイオインフォマティクス解析などが、本アプローチで統合されているリードアウトです。
編集細胞のT細胞活性化アッセイによる機能解析
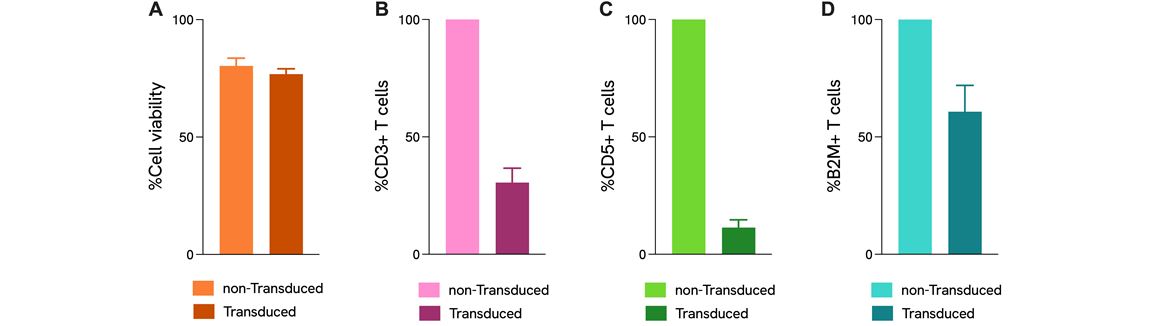
T細胞におけるプール化CRISPRノックアウトスクリーニング。ヒトCD3 T細胞に、3つの遺伝子を標的とする9つのCRISPR RNAガイドでレンチウイルス導入し、プールスクリーニング形式でCas9 RNPでエレクトロポレーションしました。A) 編集T細胞の生存率(非導入対照との比較)B-D) フローサイトメトリーにより測定したCD3、CD5、B2Mのノックアウト効率を全生存リンパ球に対する表面マーカー発現のパーセンテージで示しています。データは非導入コントロールに対して正規化しました。LentiBoost-Pは導入エンハンサーとして使用しました。ドナー:n=3

