- ゲノム編集
- Pin-point™ 塩基編集プラットフォーム
- Pin-point™ 試薬
- Pin-point™化学合成 sgRNA Non-targetingコントロール
Pin-point™化学合成 sgRNA non-targetingコントロール
| Pin-point™化学合成 sgRNA non-targetingコントロールは、Pin-point 塩基編集実験のネガティブコントロールとして使用するよう設計および推奨されています。これらのnon-targetingコントロールは Pin-point 塩基編集複合体と作用しますが、ヒトゲノムの PAM 隣接部位を標的とすることはありません。これらのコントロールで処理した細胞の生存率や遺伝子発現レベルの変化は、標的特異的Pin-point化学合成sgRNAで処理した細胞のレベルと比較できるベースラインの細胞応答を反映していると考えられます。
Highlights
|
128nt Pin-Pont sgRNAはこちらからお申し込みいただけます。
|
Pin-pointプラットフォームによる塩基編集は、DNAの二本鎖切断やインデル(indel)を形成することなく、特異的なヌクレオチド変化を誘導します。
このシステムは3つのコンポーネントから構成されています:
[1] DNAの一本鎖のみを切断または「ニッキング」するウラシルグリコシラーゼ(UGI)阻害剤と融合したヌクレアーゼ欠損「ニッカーゼ」nCas9(Komor, 2016)
[2] アプタマー結合タンパク質と融合したシチジンデアミナーゼ塩基編集酵素(Rat APOBEC)。シチジンデアミナーゼ酵素は、塩基対が編集ウィンドウ(プロトスペーサーのPAM遠位端の4から8位)内にある場合、C-G塩基対をT-A塩基対に変換します(Collantes, 2021)。
[3] nCas9とアプタマー:デアミナーゼ融合体を特定のDNA標的部位に誘導するアプタマー性シングルガイドRNA(sgRNA)。
哺乳類細胞に3つの構成要素すべてを導入することで、標的部位のC-GからT-Aへの塩基変換が誘導されます。このシステムは、遺伝子ノックアウト(未成熟終止コドンの導入(Billon, 2017)、スプライスドナーおよびスプライスアクセプター部位の破壊(Webber, 2019))、または点突然変異の導入に使用できます。
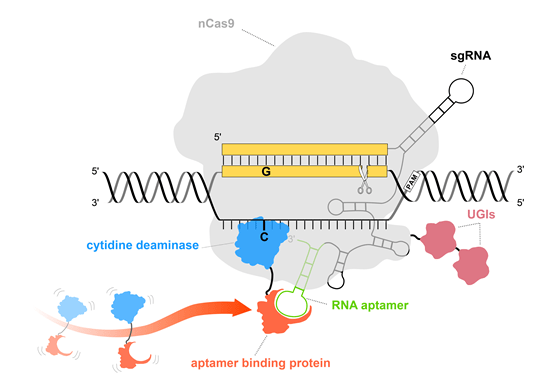
Pin-point塩基編集システムの概要図
nCas9(薄い灰色)を利用することで、DNAの二本鎖切断が起こらず、DNA損傷応答経路がトリガーされません。Pin-point sgRNAにはアプタマー(緑)が含まれており、アプタマー結合タンパク質(オレンジ)を介してデアミナーゼ(青)をリクルートし、塩基編集を行います。
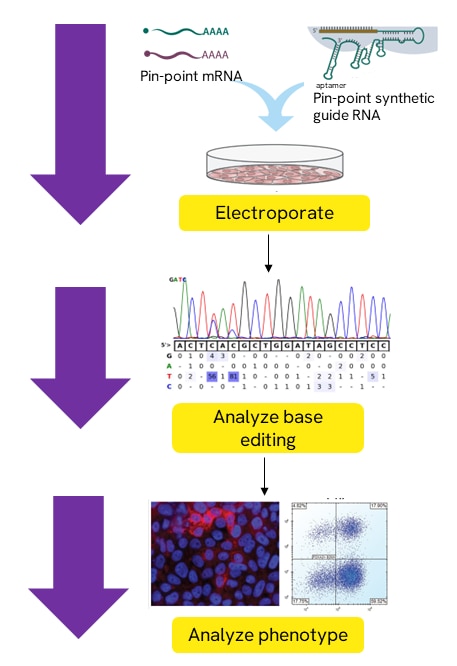
Pin-point nCas9 mRNA、Pin-point Rat APOBEC mRNA、Pin-point synthetic sgRNAを用いた塩基編集
3つのコンポーネントすべてを目的の特定の細胞にエレクトロポレーションします。その後、目的の塩基編集領域を増幅し配列決定するための解析プライマーを用いて塩基編集を観察することができます。表現型を解析し、標的タンパク質のノックアウトを評価することができます。
Table 1 Pin-point mRNA必要量
| ウェル/フォーマットサイズごとの反応数* | ||||
|---|---|---|---|---|
| HEK 293T細胞(96ウェルプレートで50,000細胞/ウェル) | T細胞(24ウェルプレートで250,000細胞/ウェル) | |||
| Pin-point nCas9 mRNA | Pin-point Rat APOBEC mRNA | Pin-point nCas9 mRNA | Pin-point Rat APOBEC mRNA | |
| 1 µg/well | 0.1 µg/well | 1.56 µg/well | 0.22 µg/well | |
| 20 µg | 20 | 200 | 12 | 90 |
| 100 µg | 100 | 1000 | 64 | 450 |
| 500 µg | 500 | 5000 | 320 | 2252 |
Table 2 Pin-point sgRNA必要量
| ウェル/フォーマットサイズごとの反応数* | ||||
|---|---|---|---|---|
| HEK 293T細胞(96ウェルプレートで50,000細胞/ウェル) | T細胞(24ウェルプレートで250,000細胞/ウェル) | |||
| 60 pmol/well | Singleplex 20 pmol/well or Multiplex (3 guides) at 20 pmol/well each |
|||
| 2 nmol | 33 | 100 | ||
| 5 nmol | 83 | 250 | ||
| 10 nmol | 166 | 500 | ||
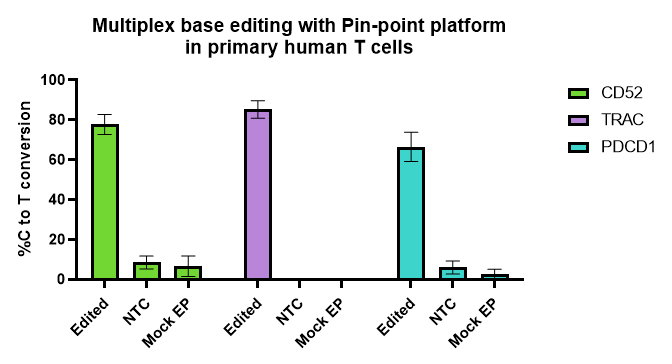
初代ヒトT細胞におけるマルチプレックス塩基編集
Pin-point塩基編集プラットフォームは、多くの実験やT細胞ドナーにおいて効率的で再現性が良好です。活性化T細胞に、Pin-point mRNAと3つの標的(CD52、PDCD1、TRAC)に対するPin-point化学合成sgRNA、またはnon-targetingコントロール(NTC #1)sgRNAをエレクトロポレーションしました。Mockエレクトロポレーション(EP)細胞をネガティブコントロールとして使用しました。エレクトロポレーション後6~7日目に細胞を回収し、Pin-point解析用プライマーを用いてPCR産物のサンガー配列決定データから塩基編集レベルを算出しました。
T細胞ドナー(N = 8)、5つの独立した実験、二重または三重のテクニカルレプリケート。ヒゲは平均値 ± SD
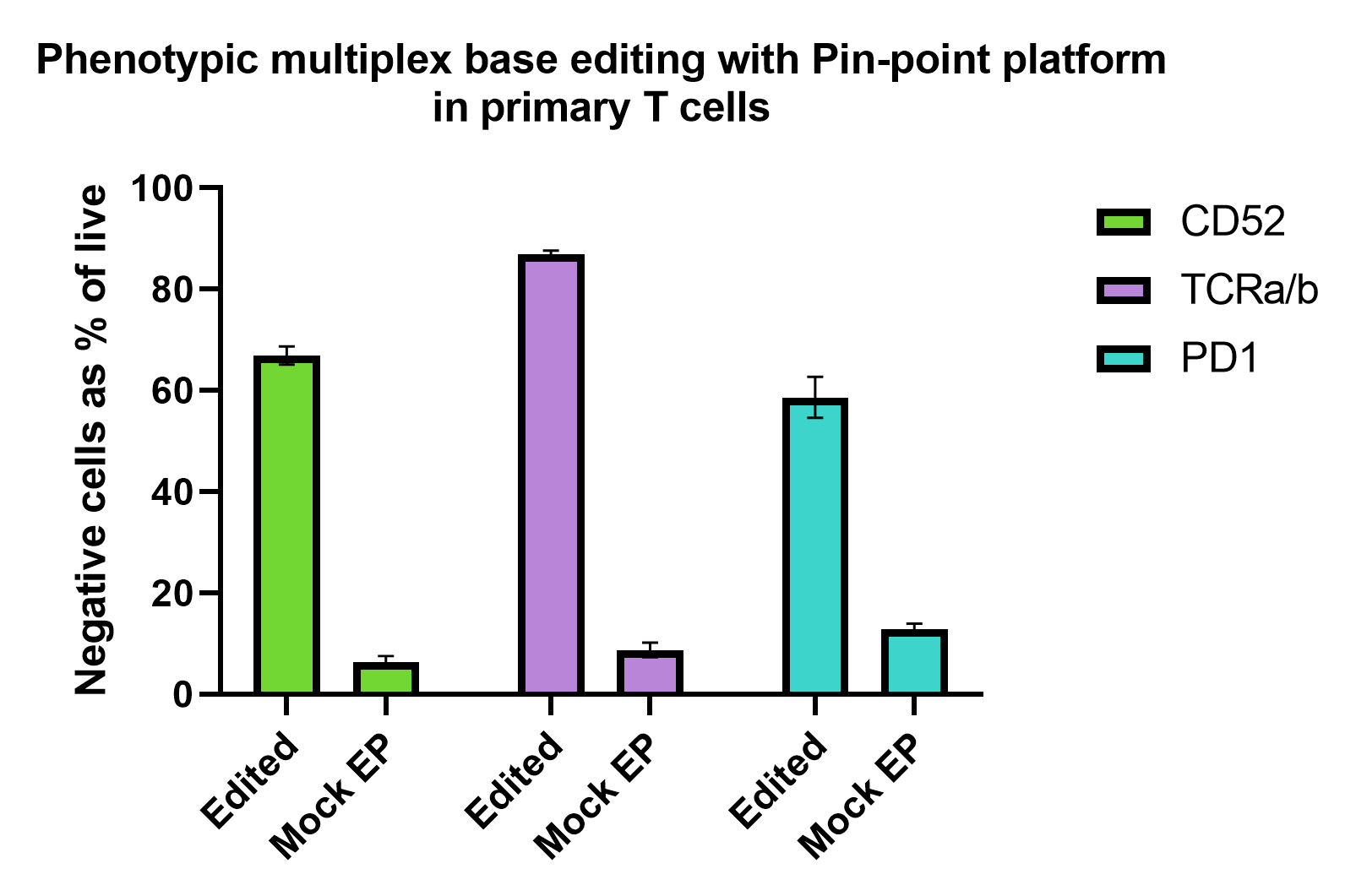
初代ヒトT細胞におけるマルチプレックス塩基編集の表現型解析
Pin-point塩基編集プラットフォームは、初代T細胞を効率的に多重遺伝子ノックアウトします。活性化T細胞に、3つの標的(CD52、PDCD1、TRAC)に対するPin-point mRNAおよびPin-point化学合成sgRNAをエレクトロポレーションし、7日後にフローサイトメトリーで解析しました。PD1の発現を誘導するために、T細胞は48時間前にPMA(phorbol 12- myristate 13-acetate)とイオノマイシンの存在下で培養しました。CD52とTCRa/bの発現は非刺激細胞を用いて分析しました。図は、編集サンプルおよびモックエレクトロポレーション(EP)サンプルの、生細胞における各マーカー陰性細胞の割合示しています。
T細胞ドナー(N = 2)の二重または三重のテクニカルレプリケート。ヒゲは平均値 ± SD
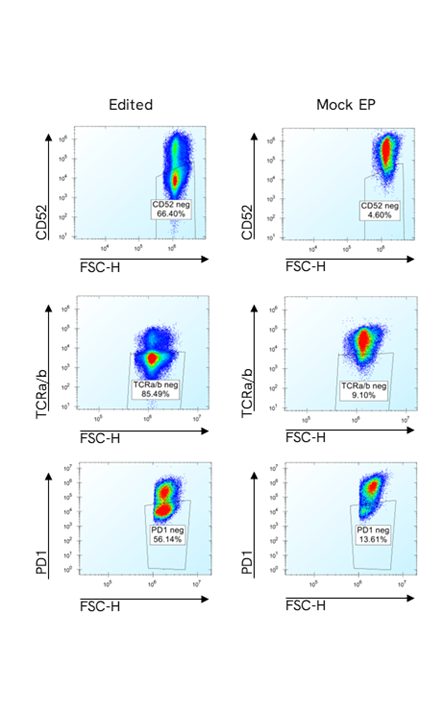
初代ヒトT細胞におけるマルチプレックス塩基編集のフローサイトメトリープロット
編集サンプルとコントロールサンプルの、3つの各マーカーの代表的フローサイトメトリープロット。各マーカーの陰性細胞のゲーティングは生細胞で行われています。

塩基編集によるトリプルノックアウトの編集効率
サンプル中の3つのマーカー(CD52、PD1、TCRa/b)が同時に陰性である細胞の割合。Pin-pointプラットフォームで編集したサンプル、およびモックエレクトロポレーション(EP)コントロールで、追加濃縮を行わず、生細胞における割合として示されています。PD1の発現を誘導するため、3つのマーカーを同時に定量できるように、分析前にT細胞をPMA(phorbol 12- myristate 13-acetate)とイオノマイシンの存在下で48時間培養しました。
T細胞ドナー(N = 2)、二重または三重のテクニカルレプリケート。ヒゲは平均値 ± SD
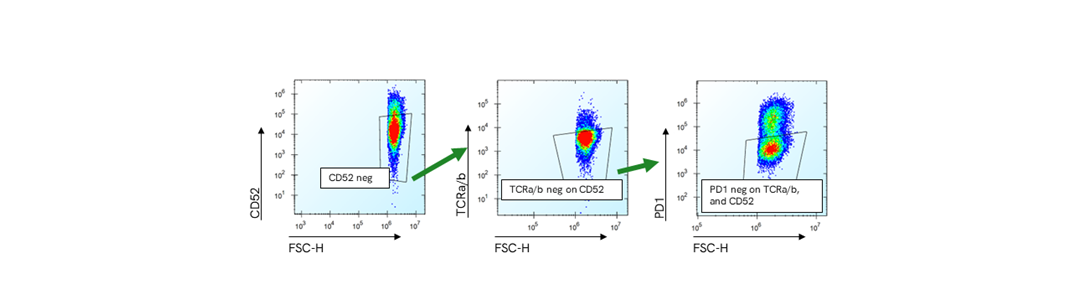
トリプルノックアウト塩基編集のフローサイトメトリーゲーティング戦略
編集サンプルの代表的フローサイトメトリープロットでゲーティング戦略を示しています。左より、生細胞でゲーティングされたCD52陰性集団、CD52陰性集団でゲーティングされたTCRa/b陰性集団、CD52とTCRa/b二重陰性集団でゲーティングされたPD1陰性集団。右端のゲートの細胞数は、3つのマーカーすべてが陰性細胞となります。トリプル陰性の細胞数は生細胞数で正規化し、上図にその割合を示しています。
Posters
-
Performance and modularity of Revvity's Pin-point base editing system characterized by arrayed and pooled screening platforms - poster
-
Pin-point™ base editing system: a versatile editing platform driving cell therapies - poster
-
The Pin-point™ base editing platform streamlines the generation of hypoimmunogenic iPSCs for allogeneic cell therapy - poster
Quick protocols
Safety data sheets
Related Products
Pin-point™塩基編集mRNAシステムは、二本鎖切断を誘発することなく、また相同性組換え修復を必要とすることなく、正確に指向性のある点突然変異の編集を可能にします。
DNAの二本鎖切断を誘発することなく、正確な遺伝子編集を行うための最適なパラメータを検証するための、化学合成sgRNAコントロール
